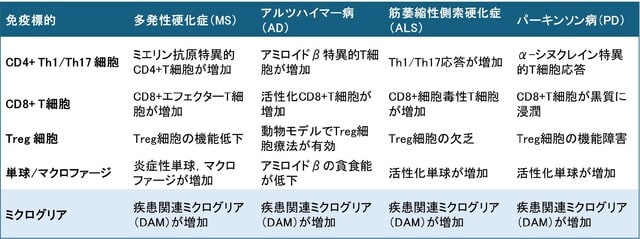
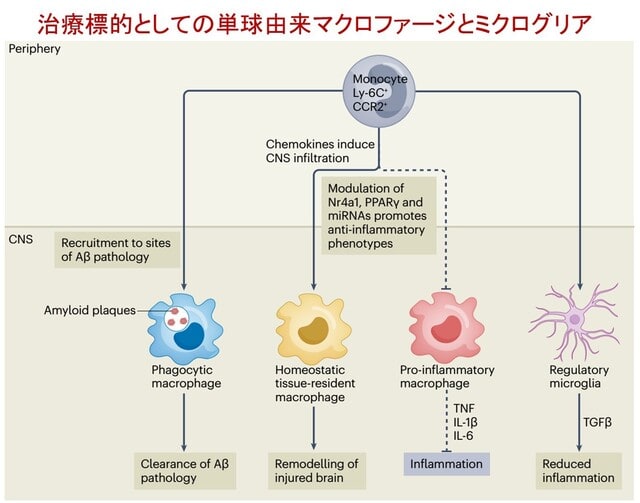
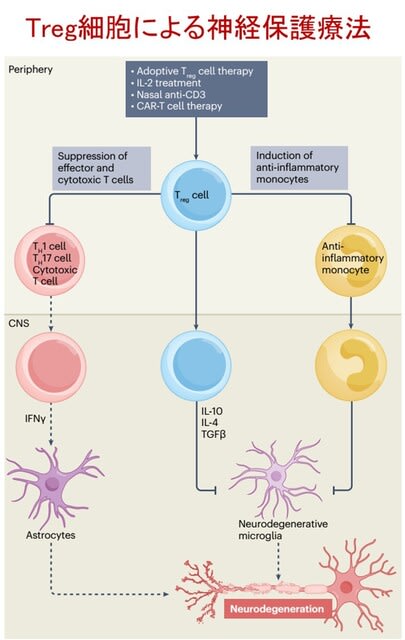
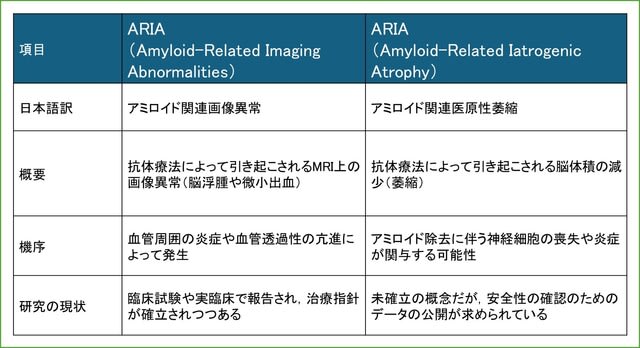
日本神経学会ではキャリア形成促進を目的とした委員会を組織し,バーンアウト対策などのウェブセミナーを行ってまいりました.本年度2回目のテーマは「リーダーシップ(オーガナイザー:海野佳子先生)」です!「リーダーシップ」は米国神経学会をはじめ多くの学会が熱心に取り組んでいるテーマです.リーダーシップを学ぶことは,組織や社会に貢献することに役に立ちますし,さらに自己実現のためにも有益です.
重要なことは,リーダーシップは「もともと備わった才能」ではなく「学んで身につけるもの」であるということです.私も意識してリーダーシップについて勉強してきましたが,その経験を活かし「リーダーシップを学ぶ―その歴史と理論―」という講演をさせていただきます.とくに7つの歴史的理論と,身につけるべきリーダーシップについて説明したいと思います(①特性理論,②行動理論,③条件適合理論,④変革のリーダーシップ,⑤EQリーダーシップ,⑥サーヴァント・リーダーシップ,⑦オーセンティック・リーダーシップ).ほかにも,米国のリーダーシップ教育,アカデミアのリーダーシップ,そして重要項目「変革のリーダーシップ」のご講演もあります.どなたでもご参加いただけますので,下記よりお申し込みください.
日程: 2025年3月29日(土) 13:00〜15:00
日本神経学会HP お知らせ→ https://www.neurology-jp.org/news/news_20250226_01.html
参加申込みはこちら→ https://online-conference.jp/jsn2024careerseminer2/register

重要なことは,リーダーシップは「もともと備わった才能」ではなく「学んで身につけるもの」であるということです.私も意識してリーダーシップについて勉強してきましたが,その経験を活かし「リーダーシップを学ぶ―その歴史と理論―」という講演をさせていただきます.とくに7つの歴史的理論と,身につけるべきリーダーシップについて説明したいと思います(①特性理論,②行動理論,③条件適合理論,④変革のリーダーシップ,⑤EQリーダーシップ,⑥サーヴァント・リーダーシップ,⑦オーセンティック・リーダーシップ).ほかにも,米国のリーダーシップ教育,アカデミアのリーダーシップ,そして重要項目「変革のリーダーシップ」のご講演もあります.どなたでもご参加いただけますので,下記よりお申し込みください.
日程: 2025年3月29日(土) 13:00〜15:00
日本神経学会HP お知らせ→ https://www.neurology-jp.org/news/news_20250226_01.html
参加申込みはこちら→ https://online-conference.jp/jsn2024careerseminer2/register