朝のカンファレンスで,味覚性発汗(gustatory sweating)とFrey症候群について議論しました.まず味覚性発汗とは味覚刺激により顔面に発汗が生じる現象で,一部の健常者には生理的味覚性発汗が認められますが,耳介側頭症候群(Frey 症候群)や交感神経切除後に生じる味覚性発汗など病的なものもあります.
Frey症候群は,耳側側頭神経(V3:下顎神経の分枝)が耳下腺周囲の手術などで損傷した際に生じます.同神経に含まれる唾液を分泌する副交感神経と発汗を引き起こす交感神経の間で異常な再生や交差神経支配が生じ,味覚刺激により顔面や頭皮で発汗が増加します.私は,Frey症候群は耳介周囲の発汗と記憶していたのですが,頭皮も発汗するようです(文献1).あと手術もなく両側性に生じた症例も報告されていました(文献2).耳下腺炎や帯状疱疹でも生じるようです.治療は発汗部位へのボトックスが有効のようです.

Freyという人物について知らなかったのでいつもの趣味で調べてみました.Lucja Frey(1889-1943?)という女性の神経内科医でした(文献3).1889年に現在のウクライナのリヴィウで生まれ,1923年にワルシャワ大学で医学の学位を取得.1925年に神経内科医としての資格を得た後,ワルシャワ大学の神経学クリニックで1928年まで勤務しました.この間,彼女は43本の学術論文を執筆しました.1923年,先生は耳介側頭神経の損傷により発生する味覚性発汗の病態生理を解明し,論文を発表しました.この病態を示す詳細な解剖学的図を示しています.
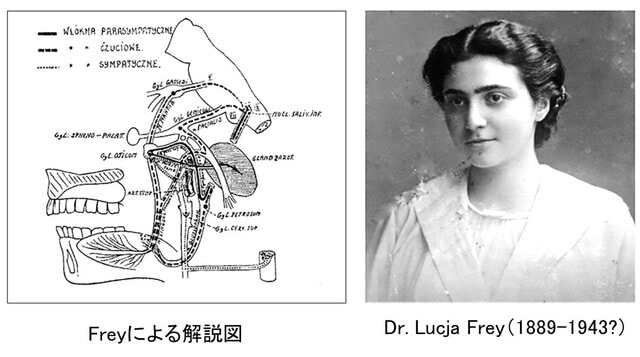
しかし,第二次世界大戦中のナチスによるユダヤ人迫害により,Frey先生の運命は一変します.ナチスはポーランドに,ユダヤ人を隔離するための強制居住地域(ゲットー:Ghetto)を多数設置しました.有名なものとして,ワルシャワ・ゲットー,クラクフ・ゲットー,リヴィウ・ゲットーなどがあります.1941年にドイツ軍がリヴィウを占領すると,彼女はゲットーに移送されます.そのなかのクリニックで医療活動を続けましたが,1943年にはクリニックの職員や患者とともに殺害されたか,強制収容所に送られたとされています.Frey先生の名前は,彼女が残した功績とともに,困難な時代を生き抜いた医療者の象徴として記憶されるべきと思いました.
1) Landman A, et al. Teaching neuro-image: a case of gustatory hyperhidrosis. Acta Neurol Belg. 2024 Apr;124(2):639-640.
2) Patrick B, et al. Botulinum Toxin for the Treatment of Postmenopausal Craniofacial Hyperhidrosis. Cureus. 2024 Sep 1;16(9):e68401.
3) Redleaf M. The Auriculotemporal Nerve Syndrome, Lucja Frey, and the Holocaust. Ear Nose Throat J. 2023 Sep 14:1455613231199357.
Frey症候群は,耳側側頭神経(V3:下顎神経の分枝)が耳下腺周囲の手術などで損傷した際に生じます.同神経に含まれる唾液を分泌する副交感神経と発汗を引き起こす交感神経の間で異常な再生や交差神経支配が生じ,味覚刺激により顔面や頭皮で発汗が増加します.私は,Frey症候群は耳介周囲の発汗と記憶していたのですが,頭皮も発汗するようです(文献1).あと手術もなく両側性に生じた症例も報告されていました(文献2).耳下腺炎や帯状疱疹でも生じるようです.治療は発汗部位へのボトックスが有効のようです.

Freyという人物について知らなかったのでいつもの趣味で調べてみました.Lucja Frey(1889-1943?)という女性の神経内科医でした(文献3).1889年に現在のウクライナのリヴィウで生まれ,1923年にワルシャワ大学で医学の学位を取得.1925年に神経内科医としての資格を得た後,ワルシャワ大学の神経学クリニックで1928年まで勤務しました.この間,彼女は43本の学術論文を執筆しました.1923年,先生は耳介側頭神経の損傷により発生する味覚性発汗の病態生理を解明し,論文を発表しました.この病態を示す詳細な解剖学的図を示しています.

しかし,第二次世界大戦中のナチスによるユダヤ人迫害により,Frey先生の運命は一変します.ナチスはポーランドに,ユダヤ人を隔離するための強制居住地域(ゲットー:Ghetto)を多数設置しました.有名なものとして,ワルシャワ・ゲットー,クラクフ・ゲットー,リヴィウ・ゲットーなどがあります.1941年にドイツ軍がリヴィウを占領すると,彼女はゲットーに移送されます.そのなかのクリニックで医療活動を続けましたが,1943年にはクリニックの職員や患者とともに殺害されたか,強制収容所に送られたとされています.Frey先生の名前は,彼女が残した功績とともに,困難な時代を生き抜いた医療者の象徴として記憶されるべきと思いました.
1) Landman A, et al. Teaching neuro-image: a case of gustatory hyperhidrosis. Acta Neurol Belg. 2024 Apr;124(2):639-640.
2) Patrick B, et al. Botulinum Toxin for the Treatment of Postmenopausal Craniofacial Hyperhidrosis. Cureus. 2024 Sep 1;16(9):e68401.
3) Redleaf M. The Auriculotemporal Nerve Syndrome, Lucja Frey, and the Holocaust. Ear Nose Throat J. 2023 Sep 14:1455613231199357.