
![]()
![]()

10 先 進 せんしん
---------------------------------------------------------------------
「顔淵死す。子曰く、『ああ、天われを喪ぼせり。天われを喪ぼせり』」(9)
「いまだ生を知らず、いずくんぞ死を知らん」(12)
「過ぎたるは、なお及ばざるごとし」(16)
「道をもって君に沢え、不可なれば止む」(24)
「なんぞ必ずしも書を読みて、然る後に学ぶとなさんや」(25)
---------------------------------------------------------------------
23.孔子の一行が匡(きょう)で暴徒にとり囲まれた。顔回だけが一行から
はぐれ、その場に居あわせなかった。ようやく追いついた顔回を見るなり、孔
子は叫んだ。
「おお、生きていたか」
顔回は静かに答えた。
「先生の生きておられますかぎり、どうしてわたしが先に死ねましょう」

![]()
【ポストエネルギー革命序論146】
26年には約4兆円規模 太陽光発電ガラス市場予測
Allied Market Researchが発行した新しいレポートでは、2018年に45億ドル
に相当する世界の太陽光発電ガラス市場は、2026年までに376億ドルに達し、
30.3%の複合年間成長率(CAGR)で拡大すると見られています。太陽光発電
(PV)ガラスは、太陽電池を窓、電子ディスプレイ、その他の透明な表面に
統合して、太陽エネルギーを電気に変換する方法として近年登場。太陽電池
は、特別な樹脂を充填した2つのガラス板の間に固定されています。これら
の樹脂は、太陽電池をあらゆる面からしっかりと包みます。各セルは2つの
電気接続で接続され、他のセルに接続されてモジュールを形成する。この新
興産業にその名を刻むことを目指しているそのような企業の1つがOnyx Solar
です。そのガラスは、マイアミヒートスタジアム、ドバイフレーム、コロラド
のサイエンスピラミッド、オーストラリアのノースコートにあるザジェネラル
として知られる受賞歴のある住宅の建設など、5大陸のプロジェクトで使用さ
れている。クリーンなソースから電気を生成することに加えて、ガラスは高い
断熱性と防音性を提供し、有害な太陽放射から保護します-UVの99%とIR放射
の95%を除去します。天窓、カーテンウォール、天蓋、ルーバーなど、建物の
エンベロープのさまざまな部分にある従来のガラスを置き換える。 2016年、
Onyx Solarはフロリダ州マイアミのアメリカンエアラインズアリーナの入り口
に太陽光発電ガラスを設置し、約300の結晶シリコンPVガラスユニットがオン
サイトでの消費のために年間34,500 kWhの太陽光発電を生産。 Onyx Solarに
よるその他のプロジェクトには、最初の太陽光発電の歩行可能な床や、電子機
器を充電できる太陽光発電家具が含まれる。世界のソーラーPVガラス市場に関
与する他の主要企業については、Allied Market Researchのレポートで詳述さ
れている。
30分で新型ウイルス、迅速検出
開発する新型コロナウイルスRNA検出試薬は、栄研化学株式会社が開発した
27日、神奈川県衛生研究所と理化学研究所は、新型コロナウイルスを30
分以内に検出できる新技術を開発したことが公表され、早速詳細調査するこ
とに。その前に、現在、主流のPCR法は検出まで1~2時間かかるが、新
たに開発されたスマートアンプ法では、10~30分と迅速に検出でき、感
度もPCR法と同等以上だという。 県衛生研などは、クルーズ船「ダイヤ
モンド・プリンセス」に乗船していた感染者から採取した新型ウイルスの検
体を用い、新技術の有用性を確認したという。実用化には体外診断用医薬品
としての承認が必要で、県などは引き続き実証研究を進める。理研の臼井健
悟・開発ユニットリーダーは「まだ2合目くらいの印象だが、実用化に向け
た第一歩を踏み出せた」と語っている。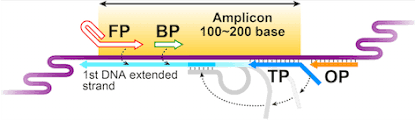
開発する新型コロナウイルスRNA検出試薬は、栄研化学株式会社が開発した
LAMP法(注3)を原理としたもので、キヤノンメディカルシステムズ株式会社が
提供する小型等温増幅蛍光検出装置で検出する。従来法(リアルタイムPCR
法)----ポリメラーゼ連鎖反応(polymerase chain reaction, PCR)はDNA
を増殖させるための原理またはそれを用いた手法。手法はPCR法と呼ばれる
場合が多い---に比べて簡便かつ短時間で検出できることが特長で、現場近
くでの検査により適していた。PCR法では「①熱変性→②アニーリング→③
伸長反応」という3段階の温度変化による反応を繰り返すことで、理論的
にはDNA量を指数関数的(2n倍:2倍、4倍、8倍…)に増幅させることが
できる。このため 約20サイクル後には理論的に100万倍にまで目的DNA
を増幅させることができ、PCR法での温度変化は専用の装置(サーマルサイク
ラー)を用いて行うので操作自体は簡単である。PCRは、反応チューブの中に、
①鋳型DNA、②プライマー、③耐熱性DNAポリメラーゼ、④dNTP、⑤Mg2+を含
む緩衝液が含まれている必要がある。
【原理】
PCR法は以下の3つの段階を繰り返すことによりDNAを増幅する。まず、92
〜95℃でDNA を①熱変性させ一本鎖とし、次に、任意の温度でプライマー
を②アニーリングさせます。最後に、72℃でDNAの③伸長反応を行います。
PCRでは、これを1サイクルとして、サイクルが1回行われるごとにDNA量を
2倍に増幅する。
特開2020-018295 改良されたウイルス検出方法
このように、核酸増幅法は数コピーの標的核酸を可視化可能なレベル、すな
わち数億コピー以上に増幅する技術であり、生命科学研究分野のみならず、
遺伝子診断、臨床検査といった医療分野、あるいは、食品や環境中の微生物
検査等においても、広く用いられている。代表的な核酸増幅法(PCR)は、
(1)熱処理によるDNA変性(2本鎖DNAから1本鎖DNAへの解離)、
(2)鋳型1本鎖DNAへのプライマーのアニーリング、(3)DNAポリ
メラーゼを用いた前記プライマーの伸長、という3ステップを1サイクルと
し、このサイクルを繰り返すことによって、試料中の標的核酸を増幅する方
法である。アニーリングと伸長を同温度で、2ステップで行う場合もある。
RNAを分析する場合、このPCRの前段として、鋳型RNAをcDNAに
変換する逆転写(RT)を実施。これをRT-PCRという。このRT-P
CRは、(1)RT、PCRを非連続に実施する2ステップRT-PCR、
(2)RT、PCRを、単一酵素を利用して連続して実施する一酵素系1ス
テップRT-PCR、(3)逆転写酵素とDNAポリメラーゼの2種類の酵
素を利用して、RT、PCRを連続的に実施する二酵素系1ステップRT-
PCRの3つに大別される。RT-PCRのうち、遺伝子検査やウイルス検
査では、処理能力の高さや、反応途中での反応容器の開閉によるコンタミネ
ーションを回避するため、1ステップRT-PCRが好まれる。二酵素系1
ステップRT-PCRでは、逆転写酵素とDNAポリメラーゼの少なくとも
2種類の酵素が使用される。一方で、一酵素系1ステップRT-PCRでは、
Tth DNAポリメラーゼなどの逆転写活性を併せ持つDNAポリメラー
ゼが利用される。
しかし、DNAポリメラーゼの逆転写酵素活性は一般に、レトロウイルス由
来の逆転写酵素の逆転写効率には劣ることから、二酵素系1ステップRT-
PCRの方が、一酵素系RT-PCRに比べて感度が高いとされている(非
特許文献1)。従って、一酵素系1ステップRT-PCRは、二酵素系RT
-PCRに比べて高感度化が難しいと考えられてきた。ウイルス検査の代表
例として、病原性RNAウイルスの一つであるノロウイルスが挙げられる。
ノロウイルスは、急性胃腸炎の原因となる1本鎖RNAウイルスである。感
染力が強く、集団食中毒や集団感染を引き起こすことから、公衆衛生上関心
の高いウイルスである。ノロウイルスGⅠ及び(GⅡ)の2つの遺伝子群に
分類される。ノロウイルスの病原体検査では、組織培養法が確立できておら
ず、電子顕微鏡法、ELISAによる免疫学的抗原検出法、または核酸増幅
技術を利用したウイルス遺伝子の検出法が開発されている。このうち、日本
においては、厚生労働省医薬食品局安全部監視安全課の通知(食安監110
5001号)に基づくRT-PCR法が公定法として普及している。ノロウ
イルスの感染の原因として主にノロウイルスに汚染された食品を飲食するこ
とによるが、ヒトの手を介した感染が多いため、調理施設、医療現場、老人
介護施設及び保育園などでは定期的な検便検査が求められている。大量調理
施設衛生管理マニュアルには、調理従事者等の検便検査に、月に1回以上又
は必要に応じノロウイルスの流行期である10月から3月についてノロウイ
ルスの検査を含めることが追加される。これはウイルスに感染していても症
状がでない人(健康保因者)が少なからず存在し、これらの人たちが知らず
知らずのうちに感染を広げる可能性があるためである。さらに、下痢や嘔吐
などの症状がある調理従事者は医療機関を受診し、ノロウイルスに感染して
いることが判明した場合はリアルタイムPCR等の高感度検査を実施し、ノ
ロウイルスを保有していないことが確認されるまでは食品に直接触れる調理
作業を控えるなどの適切な処置をとることが望まれている。(中略)
【要約】
従って、試料中のRNAウイルスの存在の有無を検査方法で、核酸の単離処
理も加熱処理も行っていない試料と、逆転写活性を有する耐熱性DNAポリ
メラーゼを含む一酵素系1ステップRT-PCR反応液とを混合する工程及
び反応容器を密閉後、1ステップRT-PCR反応を実施する工程、を包含
することで、試料から核酸の単離や試料の事前の加熱処理を行うことなく、
一酵素系1ステップRT-PCR反応液と試料とを直接混合し、1ステップ
RT-PCRを実施することによりウイルスの有無の検出を可能とする方法
およびキットを提供できる。
【結果】
G1、G2 RNAの増幅曲線を図1に示す。条件1から条件4について、
耐熱性DNAポリメラーゼの量を増加させるに従って、G1、G2共に増幅
曲線の到達蛍光強度が減少した。この傾向は、ノロウイルスGⅡ型の検出に
おいて顕著であった。この結果は、反応液中のポリメラーゼ量が増加するに
従って、非特異増幅が増加していることを示唆している。
図1
【特許文献1】 特開2018-000138号公報
特開2019-129798:
加熱サンプルを用いたより迅速で効率的な等温増幅
このように、①核酸を増幅する方法として、ポリメラーゼ連鎖反応法(PC
R法)が広く知られている。②RNAの場合、逆転写酵素によって一旦cD
NAを合成してからPCR法を行なう、また標的核酸がRNAの場合、いわ
ゆるRT-PCR法が知られているが、PCR法およびRT-PCR法は急
激に何度も反応温度を昇降させる必要があり、自動化の際の反応装置の省力
化や低コスト化のための障壁となっている。③一方、RNAを標的として一
定温度で核酸を増幅する方法としてNASBA法(特許文献1および2)、
TMA法(特許文献3)、TRC法(特許文献4および非特許文献1)とい
った方法が知られている。これらの方法は、反応温度を昇降させることなく
一定温度で核酸が増幅する等温増幅反応のため、簡便に核酸を増幅すること
ができる。そのため自動化の際の反応装置省力化や低コスト化ができる点で
好ましい。感染症の臨床検査分野においては、簡便、迅速かつ高感度に病原
体を検出することが重要である。高感度に病原体を検出する方法として、核
酸増幅法を利用した検出法が知られている。しかし、これらの核酸増幅反応
は、緊急を要する場合がしばしばある臨床検査分野ではより短時間に結果を
得ることが求められている。等温増幅反応において、等温増幅反応を実施す
る温度よりも高い温度のサンプルを添加する標的核酸を増幅し検出する方法
を用いることで、より迅速で効率的な等温増幅反応により、標的核酸を増幅、
検出する方法を提供する。
【NASBA法:前出特許文献1】
第2650159号 核酸増幅方法
標本中に存在する特定の核酸配列を検出するために核酸の相補的配列で標本
をプローブすることは公知の診断方法で使用されている。核酸と相補的核酸
との結合は高度に特異的であり、従って標本中に特定の核酸が存在するか否
かを有効に判定し得る。このためには、検出すべき特定核酸配列が既知であ
り該特定配列に相補的な核酸配列をもつプローブを構築することが必要であ
る。本願において、「特定核酸配列」なる用語は、増幅させるべき一重鎖ま
たは二重鎖の核酸を意味する。「標本」なる用語は、複数の核酸を含有する
混合物を意味する。「十分に相補的な」なる用語は、2つの核酸即ちプライ
マーと鋳型とが特異的に相互作用でき所与のイオン強度条件及び温度条件下
にプライマー依存性で鋳型依存性のDNA合成を有効に行なうことを意味する。
核酸プローブは高度に特異的であるため、いくつかの場合には、核酸配列に
よって産生されるタンパク質よりもむしろ核酸配列自体をプローブするほう
が好ましい。例えば、タンパク質検出だけに基づく診断方法では、B型肝炎
ウィルスの感染性粒子の存在に関して信頼できる診断を下すことができない。
その理由は、DNAゲノムの欠失した非感染性抗原粒子が有意レベルで存在す
るからである。別の例では、前癌性または良性の子宮頚部腫瘍中に検出され
るヒト乳頭腫ウイルスの種々のサブタイプは核酸プローブハイブリダイゼー
ションを使用したときにのみ識別できる。またエイズの微生物学的研究から
も、エイズ特異的核酸配列の存在に基づくアッセイが最良の診断方法である
ことが確認された。
既存の核酸プローブ技術の使用に伴う最大の困難及び既存のプローブ技術の
実用性に限界がある理由は、コピー数の問題にある。例えば、1つのウイル
スまたは細胞中に通常は特定遺伝子の単一コピー(single copy)が存在する。
この1つのコピーがRNAまたはタンパク質のごとき遺伝子産生物のコピーを
多数生成し得る。このため、検出すべき核酸の特定配列がタンパク質の数千
ものコピーを生じ得るので、診断方法においてはタンパク質をプローブする
技術がしばしば使用されてきた。レジオネラ(Legionella)及びマイコプラ
ズマ(Mycoplasma)のごときある種の細菌性病原体の診断を核酸プローブを
用いて容易に行なうために、細胞当り100,000コピーにのぼる多数の天然リ
ボソームRNAが遺伝子プローブ(GenProbe)法によって使用されてきた。し
かしながら、この戦略は、ウイルスのごとき非細胞性病原体には使用できな
い。核酸プローブを用いたエイズウイルス検出方法の開発ではコピー数が特
に問題になる。何故ならこの場合、組み込まれたプロウイルスは10,000個の
末梢血リンパ球のうち1個未満のリンパ球中に存在し得るからである。従っ
て、標本中に存在すると予想される特定核酸配列を増幅できれば、コピー数
の問題が解決されプローブアッセイをより容易に使用できる。少数の細胞し
か含まず従って特定遺伝子の少数コピーしか含まない正常生物標本において
は、コピー数の問題を解決するために増幅方法を利用する必要がある。
1つの増幅方法は、標本の「十分な増殖」を行なうこと、即ち標本中に存在
する生きた生物物質が自然に複製できるように条件を整えることである。核
酸配列の量を複製によって検出可能レベルまで増加させる。例えば食品産業
では、加工食品の有害細菌Sallmonellaを検査するために、食品標本を何日
間もインキュベートして核酸量を増加させる必要がある。臨床標本では、病
原体の数を増加させるために標本をかなりの期間にわたって増殖させる必要
がある。1987年7月28日付けCetus Corporationの米国特許第4,683,195号及
び1987年7月28日付けのCetus Corporationの米国特許第4,683,202号は夫々、
標本中に含まれる標的核酸配列の増幅方法を開示している。米国特許第4,683,
195号に記載された方法は、標的核酸配列を含有すると予想される標本をオリ
ゴヌクレオチドプライマーで処理してプライマー伸長産生物を合成し、該産
生物を鋳型として標的核酸配列を増幅させる方法である。好適実施例では熱
変性を用いてプライマー伸長産生成物を鋳型から分離している。また、米国
特許第4,683,202号に記載の方法は、異なる2つの相補鎖をもつ標的核酸配
列の増幅方法である。この方法では、鎖をプライマーで処理して伸長産生物
を合成し、プライマー伸長産生物を鋳型から分離し、次にプライマー伸長産
生物を鋳型として使用する。
前出の2つの米国特許はいずれも、増幅方法においてユーザーが手動的また
は機械的に介入しかつ多段階操作を行なう必要がある。これらの特許に含ま
れる操作段階では、ユーザーが標本を加熱し、冷却し、適当な酸素を添加し、
次いで諸段階を繰り返す必要がある。温度変化は酵素を失活させる。従って
ユーザーは増幅過程の際に適当な酵素のアリコートを増幅混合物に繰り返し
補充する必要がある。米国特許第4,683,195号及び第4,683,202号によれば更
に、増幅方法の各サイクルでは第1鋳型から第2鋳型が合成され、次に第2
鋳型を用いて第1鋳型が合成される。このようにしてこの手順が繰り返され
るが、増幅方法の各サイクルは1つの基質から1つの産生物の合成に基づい
ている。
従来技術に開示された増幅方法にかかわりなく、増幅方法の改良が必要と
されている。ユーザーの介入が少なく操作が少ない増幅方法が好ましい。更
に、増幅方法に関与する酵素の活性に影響を与えないように増幅が比較的一
定の室温で行なわれるのが有利である。増幅方法の各サイクル毎に1つの鋳
型を使用して1つの基質から2つ以上の産生物を生成することができれば更
に好都合であろう。
【特許請求の範囲】
【請求項1】試薬を順次添加することなく比較的に一定した温度で特定の核
酸配列を増幅するための方法であって、
(A)(i)第1のオリゴヌクレオチドプライマー、
(ii)RNAポリメラーゼプロモーターのアンチセンス配列を含む第2のオリ
ゴヌクレオチドプライマー、
(iii)前記プロモーターを認識するDNA依存性RNAポリメラーゼ、
(iv)RAN依存性DNAポリメラーゼ、
(v)DNA依存性DNAポリメラーゼ、
(vi)一重鎖または二重鎖のRNAまたはDNAを加水分解することなくRNA-DNA
ハイブリッドのRNAを加水分解するリボヌクレアーゼ、および
(vii)リボヌクレオキシドトリホスフェートおよびデオキシリボヌクレオ
シドトリホスフェートを含む単一の反応媒質を用意し、
(B) 前記特定核酸配列またはこの特定核酸配列と相補的な配列を含むRNA
第一鋳型からなるRNAを、増幅反応サイクルが生起するような条件下で、前
記反応媒質中に提供し、しかる後、
(C) 前記特定核酸配列の所望の増幅を達成するのに充分な時間前記条件
を維持するステップからなる方法。
【請求項2】前記RNA第一鋳型が前記特定核酸配列を含んでおり、ステップ
(B)が前記反応溶媒質中に一重鎖RNAを提供することを含んでおり、その
結果、
(i)前記第1のオリゴヌクレチオドプライマーが前記一重鎖RNDとハイブ
リダイズし、
(ii)前記RNA依存性DNAポリメラーゼが前記一重鎖RNAを鋳型として利用し
て前記第1オリゴヌクレオチドプライマーを伸長することによってDNA第二
鋳型を合成し、それによりRNA-DNAハイブリッドを形成し、
(iii)前記リボヌクレアーゼが、前記RND-DNAハイブリッドを構成してい
るRNAを加水分解し、
(iv)前記第2オリゴヌクレオチドプライマーが前記DNA第二鋳型とハイブ
リダイズし、
(v)前記DNA依存性DNAポリメラーゼが前記第2オリゴヌクレオチドプライ
マーを鋳型として利用して前記DNA第二鋳型を伸長することによって機能性
のRNAポリメラーゼプロモーターを合成し、
(vi)前記DNA依存性RNAポリメラーゼが前記機能性プロモーターを認識し、
かつ前記DNA第二鋳型を転写し、それにより前記RNA第一鋳型のコピーを生成
させることを特徴とする請求項1に記載の方法。
【請求項3】前記第2オリゴヌクレチオドプライマーがさらに前記DNA依存
性RNAポリメラーゼに対する転写開始部位のアンチセンス配列を含んでおり、
前記転写開始部位の前記アンチセンス配列が前記RNAポリメラーゼプロモー
ターの前記アンチセンス配列と機能可能なように結合していることを特徴と
する請求項1に記載の方法。
【請求項4】前記DNA依存性RNAポリメラーゼがバクテリオファージT7 RNA
ポリメラーゼであり、転写開始部位の前記アンチセンス配列及び機能性RNA
ポリメラーゼプロモーターの前記アンチセンス配列が一緒になって次のヌク
レオチド配列AATTCTAATACGACTCATATAGGGAGを構成することを特徴とする請求
項1に記載の方法。
【請求項5】ステップ(B)がさらに前記反応媒質にサンプルを添加するこ
とを含んでおり、その際の条件は、前記特定核酸配列またはこの特定核酸配
列と相補的な配列を含むRNA第一鋳型からなるRNAが前記サンプルによって提
供された場合に前記サイクルが生起するような条件とすること、および、ス
テップ(C)の後にさらに前記試薬(i)、(ii)および(vii)のいずれ
かの消費または前記サイクルの産物の蓄積に関して前記反応媒質をモニター
するステップ(D)を含んでいることを特徴とする請求項1に記載の方法。
【請求項6】ステップ(D)が前記サイクルの核酸産物を検出することを含
む請求項4に記載の方法
【請求項7】ステップ(D)が核酸プローブを使用して前記核酸産物を検
出することを含む請求項5に記載の方法。
【請求項8】ステップ(D)が制限エンドヌクレアーゼと電気泳動分離を使
用して前記核酸産物を検出することを含む請求項5に記載の方法。
【請求項9】ステップ(D)が前記RNA第一鋳型の蓄積をモニターすること
を含む請求項5に記載の方法。
【請求項10】ステップ(D)が前記DNA第二鋳型の蓄積をモニターするこ
とを含む請求項5に記載の方法。
【請求項11】ステップ(D)が機能性のRNAポリメラーゼプロモーターを
含有するDNAをモニターすることを含む請求項5に記載の方法。
【請求項12】ステップ(D)が前記RNA-DNAハイブリッド中間体の蓄積を
モニターすることを含む請求項5に記載の方法。
【請求項13】ステップ(D)がさらに、前記試薬(i)、(ii)および
(vii)のいずれかの消費または前記サイクルの産物の蓄積を、前記特定核
酸配列およびそれと相補的な前記配列が存在しない場合の前記反応媒質中に
おける前記試薬の消費または前記産物の蓄積に相当する値と比較することを
含む、請求項5に記載の方法。
【請求項14】前記リボヌクレアーゼが大腸菌リボヌクレアーゼHおよびト
リ骨髄芽球症ウィルスポリメラーゼのリボヌクレアーゼHからなることを特
徴とする請求項1に記載の方法。
【請求項15】前記リボヌクレアーゼが子ウシ胸腺リボヌクレアーゼHであ
ることを特徴とする請求項1に記載の方法。
【請求項16】前記第1オリゴヌクレオチドプライマーまたは前記第2オリ
ゴヌクレオチドプライマーが、固定化された支持体と可逆的に結合する、請
求項1に記載の方法。
【請求項17】前記DNA依存性RNAポリメラーゼがバクテリオファージRNAポ
リメラーゼである請求項1に記載の方法。
【請求項18】前記DNA依存性RNAポリメラーゼがバクテリオファージT7RNA
ポリメラーゼである請求項16に記載の方法。
【請求項19】前記DNA依存性RNAポリメラーゼがバクテリオファージT3ポリ
メラーゼである請求項16に記載の方法。
【請求項20】前記DNA依存性RNAポリメラーゼがバクテリオファージφ II
ポリメラーゼである請求項16に記載の方法。
【請求項21】前記DNA依存性RNAポリメラーゼがサルモネラバクテリオファ
ージsp6ポリメラーゼであることを特徴とする請求項16に記載の方法。
【請求項22】前記DNA依存性RNAポリメラーゼがPseudomonasバクテリオファ
ージgh-1ポリメラーゼであることを特徴とする請求項16に記載の方法。
【請求項23】前記RNA依存性DNAポリメラーゼがレトロウイルスリバースト
ランスクリプターゼであることを特徴とする請求項1に記載の方法。
【請求項24】前記レトロウイルスリバーストランスクリプターゼがトリ骨
髄芽球症ウイルスポリメラーゼであることを特徴とする請求項22に記載の方
法。
【請求項25】前記レトロウイルスリバーストランスクリプターゼがモロニ
ー(Moloney)マウス白血病ウイルスポリメラーゼであることを特徴とする
請求項22に記載の方法。
【請求項26】前記DNA依存性RNAポリメラーゼがエキソヌクレアーゼ活性を
もたないことを特徴とする請求項1に記載の方法。
【請求項27】前記反応媒質中のDNAポリメラーゼがいずれもDNAエキソヌク
レアーゼ活性もDNAエンドヌクレアーゼ活性ももたない、請求項1に記載の
方法。
【請求項28】前記DNA依存性DNAポリメラーゼがトリ骨髄芽球症ウイルスポ
リメラーゼである請求項1に記載の方法。
【請求項29】前記DNA依存性DNAポリメラーゼがDNAポリメラーゼαまたは
ポリメラーゼβである請求項1に記載の方法。
【請求項30】前記DNA依存性DNAポリメラーゼが子ウシ胸腺DNAポリメラー
ゼである請求項1に記載の方法。
【請求項31】ステップ(C)が前記条件を30分~4時間維持することから
なる、請求項1に記載の方法。
【請求項32】さらに、前記サイクルのDNA産物をクローニングベクターに
結合した後前記DNA産物をクローン化するステップを含む、請求項1に記載
の方法。
【請求項33】さらに、前記サイクルの前記DNA産物がコードしている産物
を発現系で発現させるステップを含む、請求項31に記載の方法。
【特許文献2】特許第3152927号
特許3152927 自己持続性、配列複製システム
【要点】
例えばヒト免疫不全ウィルス(HIV-1)の核酸に関連する核酸のごとき病
原性疾患または状態に付随するであろうポリペプチドをコードしている核酸
を検出することが望まれている。そのようなポリペプチドをコードしている
核酸の検出に加え、血友病で例示されるごとく欠陥ヒトベータグロビン遺伝
子の検出の場合のような欠陥遺伝子のごとき病原性疾患または状態に特徴的
な他の核酸の検出も望まれている。
特徴的なことは、そのようなものに付随する核酸は、与えられた血液または
他の体液のごとき生物試料または試験されるべき与えられた個体の組織試料
中の全核酸に比較すると非常に少量しか存在していないことである(あった
としてもわずかである)。そのような核酸種の検出には周りに付随する種々
の他の核酸種の中から検出可能および測定可能であるという特異性(もしあ
れば)を必要とする。これらの種のあるものは標的核酸と近い相同性をもっ
ているであろう(少くとも単離されたセグメント)。さらに、先に指摘した
ごとく、これらの標的核酸種は試験される生物試料中に非常に微量のみしか
見いだされないのが普通である。しかも、潜在する疾病状態の適切な診断の
ためには、たとえそのような標的核酸が少量でもアッセイ系の忠実さで明確
に検出可能であることが必須である。
【特許請求の範囲】
【請求項1】標的RNA配列に対応する配列をコードし、作用可能なポリメラ
ーゼ プロモーターを持つ二本鎖DNAを調整する方法で、
a)標的核酸配列のセグメントの相補体である配列を作用可能なように伴っ
たRNAポリメラーゼ プロモーター配列を含む第1のDNAプライマーを提供し、
b)適当なハイブリダイズ条件下前記の第1のDNAプライマーを前記標的核
酸配列を含んでいるであろう核酸試料と接触させ、
c)DNAポリメラーゼ伸長反応において前記第1のDNAプライマーと前記核酸
配列のハイブリダイゼーション生成物のプライマー伸長を可能にして対応す
るRNA/DNAデュープレックス核酸を生成させ、
d)前記RNA/DNAデュープレックス核酸のRNA鎖を酵素的に選択的に消化し、
e)第2の核酸プライマーの適切なハイブリダイゼーション条件下cDNA鎖を
含む遊離されたプロモーターへのハイブリダイゼーションを可能にし、前記
第2の核酸プライマーは前記選択消化の生成物であり、および
f)DNAポリメラーゼ伸長反応において、前記DNA鎖を持つプライマーのハイ
ブリダイゼーション生成物のプライマー伸長を可能にすることからなる方法。
【請求項2】前記核酸標的配列を含んでいるであろう核酸試料中の少なくと
も1つの特異的標的核酸配列の検出に有用な請求項1に記載の方法で:
g)調製された請求項1の二本鎖DNAを多数のRNA転写体(各々が前記標的核
酸配列に対応するRNA配列を運んでいる)の調製のための二本鎖DNA鋳型とし
て用いる追加段階を含む方法。
【請求項3】前記RNA配列を検定および随意に測定する追加の工程を含む請
求項2記載の方法。
【請求項4】前記核酸試料中の前記標的核酸配列が、それ自体内在的に存在
しているか、または、作用可能なプロモーター配列を持つプライマーを持つ
前記DNA標的配列のハイブリダイゼーション/プライマー伸長生成物から調
製される、作用可能なようにプロモーター配列を持つ分離されたDNA鎖へハ
イブリダイズされたプライマーのポリメラーゼによるプライマー伸長により
調製される二本鎖DNA鋳型からの転写により調製された対応するDNA標的配列
外挿生成物である請求項1,2または3の任意の1項に記載の方法。
【請求項5】h)適切なハイブリダイゼーション条件下、前記RNA転写体と
前記RNA転写体配列のセグメントの相補体である配列を作用可能なように伴
ったプロモーター配列を含むDNAプライマーとのハイブリダイゼーションを
可能にし、
i)DNAポリメラーゼ伸長反応において工程h)のハイブリダイズされた生
成物のプライマー伸長を可能にして対応するRNA/DNAデュープレックス核酸
を形成させ、
j)工程i)の前記RNA/DNAデュープレックスのRNA鎖を酵素的に選択的に
消化し、
k)適切なハイブリダイゼーション条件下、工程j)のDNA鎖生成物を含む
遊離されたプロモーターと核酸プライマーのハイブリダイゼーションを可
能にし、前記核酸プライマーは前記工程j)の選択的消化の生成物であるか、
または任意に作用可能なようにプロモーター配列を持つ外部からに由来する
オリゴヌクレオチド プライマーであり、
l)DNAポリメラーゼ伸長反応において工程k)のハイブリダイゼーション
生成物のプライマー伸長を可能にし、および
m)工程l)の二本鎖DNA生成物を多数のRNA転写物の調製のための二本鎖
DNA鋳型として用いる追加の工程を含む請求項2記載の方法。
【請求項6】RNA転写体生成物が請求項2のRNA転写体生成物と逆のセンスを
持つ請求項5記載の方法。
【請求項7】1)逆転写酵素、2)RNaseH活性を持つ酵素、3)DNA-依存
性RNAポリメラーゼおよび4)プロモーター配列を作用可能なように持つ少
なくとも1つのオリゴヌクレオチド プライマー配列により提供される酵素
活性が反応環境に存在することにより連続的および自発的に進行することが
可能になった請求項5記載の方法。
【請求項8】本質的に等温で実施される請求項7記載の方法。
【請求項9】請求項1または請求項5の工程1)による二本鎖核酸を、それ
からのプロモーターを認識するポリメラーゼにより触媒される反応において
それらの多数のRNA転写体(各々は前記標的核酸配列に対応するRNA配列を持
つ)を調製するための鋳型として用い、前記RNA転写体の存在を検出および
随意に測定することを含む方法。
【請求項10】前記転写体がRNA複製酵素誘導による前記の転写体の複製の
ためにRNA複製酵素認識部位を含んでいる請求項2または9記載の方法。
【請求項11】前記RNA転写体の検出されたRNA配列が前記試料にも含まれて
いる核酸の既知のコピー数の存在による内部標準化様式で測定される請求項
2,9または10記載の方法。
【請求項12】前記標的核酸配列に遺伝的または病原的疾患または状態の特
性が付随している請求項1記載の方法。
【請求項13】前記標的核酸配列にヒト免疫不全ウィルスが付随している請
求項1記載の方法。
【請求項14】前記標的核酸配列に欠陥遺伝子が付随している請求項1記載
の方法。
【請求項15】プロモーターがバクテリオファージT7プロモーターであり、
RNA転写体がT7 RNAポリメラーゼを使用して産生される請求項1または5に
記載の方法。
【請求項16】選択的消化がRNaseH酵素により実施される請求項1または5
記載の方法。
【請求項17】伸長反応が大腸菌DNAポリメラーゼIにより触媒される請求
項1または5記載の方法。
【請求項18】伸長反応が大腸菌DNAポリメラーゼIのクレノー断片により
触媒される請求項1または5記載の方法。
【請求項19】伸長反応がT7DNAポリメラーゼにより触媒される請求項1ま
たは5記載の方法。
【請求項20】伸長反応が逆転写酵素により触媒される請求項1または5
記載の方法。
【請求項21】前記DNA転写体が検出に先立って標識される請求項2または
5記載の方法。
【請求項22】前記DNA転写体が放射性標識されている請求項21記載の方法。
【請求項23】前記RNA転写体が発色団標識されている請求項21記載の方法。
【特許文献3】 特許第3241717号公報
特許3241717 核酸配列増幅法
【特許文献4】
特開2000-014400 標的核酸の定量方法
【要点】
少なくとも第1の1本鎖オリゴ核酸、第2の1本鎖オリゴDNA、各種ポリ
メレースとその基質、第3の1本鎖オリゴDNA及び特定塩基配列に相補的
な配列を有し、該配列を有する核酸と結合した場合に測定可能な蛍光信号を
発するように標識された第4の1本鎖オリゴDNAを用い、蛍光信号を1度
以上測定する操作を含む、試料中の標的核酸の分析方法で、概ね一定の温度
で試料中の特定塩基配列を含む1本鎖RNAを分析するための簡便で精度の
高い方法であって、反応液の急激な昇温・降温操作を繰り返す操作や増幅さ
れたRNAの測定に際して担体を使用する必要がなく、密閉した容器中で全
操作を完了し得る方法を提供すること。
特開2019-95204 検出装置および検出方法
【要点】
A型インフルエンザウイルスのうち、例えばH5N1亜型に代表される鳥イ
ンフルエンザは、全身の臓器に感染が広がるため、致死率が高く強毒性と呼
ばれている。現状では、H5N1亜型はヒトには感染しにくいため、パンデ
ミックとなっていないが、変異によりヒトに感染する新型インフルエンザが
発生した場合には、壊滅的な被害が発生することが予想されている。一方、
インフルエンザの迅速検査は、イムノクロマト法などが実用化されているが、
強毒性と弱毒性の識別を行う迅速検査技術は、まだ確立しておらず、現状で
は、PCR(Polymerase Chain Reaction:ポリメラーゼ連鎖反応)法による遺
伝子増幅後の遺伝子検査が必要とされている。新型インフルエンザが発生し
てしまった際には、急速に感染が拡大することが予想されるため、迅速検査
手法がないと感染の拡大を止めることが難しいと予想される。また、ウイル
スを特異的に検出する技術としては、ウイルス表面のマーカと結合するプロ
ーブ分子を用いて捕捉する手法が知られているが、この手法では、夾雑物が、
プローブ分子やプローブ分子以外の部分へ、非特異的に吸着してしまった場
合との識別が難しく、高感度化が難しいという課題もあった。さらに同じプ
ローブ分子に結合する表面マーカを持ったウイルスがあった場合には、それ
らを識別できないという課題もあった。そこで、下図9のごとく、検出装置
は、センサ素子と、前記センサ素子に固定されたプローブ分子であって、検
出ターゲットの表面に露出した受容体と会合するプローブ分子と、を具備す
る。前記センサ素子は、前記プローブ分子と会合した前記受容体が開裂した
ことを検出することで、検出ターゲットの迅速な評価が可能な検出装置およ
び検出方法を提供する。
✔ サンプリングを含め10分以内(目標は1分以内)が開発目標です。
【符号の説明】
10…ターゲット検出素子、11…基板、12…下地膜、13…グラフェン
膜、14…リン脂質膜、15…注入口、16,17…電極、21…プローブ
分子、25…トリプシン阻害剤、31…エンベロープ、41…ハイドロゲル、
42…イオン液体、100…参照素子
【世界の工芸:#CraftsOfTheWorld#TogakuMori】
森 陶岳(もり とうがく、1937年3月23日 - )、岡山県出身の陶芸家。本名
は才蔵。両親は、岡山県備前市伊部の備前焼窯元の森秀次とけい。備前焼窯
元六姓の流れをくむ。岡山県指定重要無形文化財保持者。岡山大学教育学部
特設美術科卒後、中学の美術教師を3年で退職して陶芸の道に入る。各種の
窯を築いて焼成を重ねた末、小さな窯では「古備前の魅力」の謎解きは出来
ないとして、古備前が焼成された中世の大窯焼成計画を立てた。兵庫県相生
市内の山中に半地下直炎式登り窯(全長46メートル)を築き、1980年1月8日
から53日間窯を焚いて、ひもづくりの大甕(おおがめ)など備前陶器多数を
焼成。その直後に岡山県邑久郡牛窓町寒風(現・瀬戸内市牛窓町寒風)に移
り、ここに全長53メートルの「寒風大窯」(さぶかぜおおがま)を築き、
1986、1990、1994、1999、2005、2011年の計6回、作品を焼いた。1997年か
らは、並行して前人未踏といわれる「寒風新大窯」(全長85メートル・幅6
メートル・高さ3メートル)の築窯に着手した。 2005年から弟子たちと古備
前が生産された大窯時代の共同作業の仕組みを取り入れ、2008年夏に寒風新
大窯を完成させた。新窯の性能を確かめる空焚き(からだき)も成功させた。
2015年信念からこの登り窯を用いて、約1年かけて備前焼初窯焼成を行う。
●遂に滋賀も発症したか。「オー・パンデミック!?」![]()



























※コメント投稿者のブログIDはブログ作成者のみに通知されます