Science誌にアルツハイマー病(AD)研究史において恐らくepoch makingとなる重要な発見が報告されています.ADをはじめとするタウオパチーと総称される20以上もの疾患では,微小管関連タンパク質であるタウが異常リン酸化し,線維化した神経原線維変化(NFT)によって病理学的に定義されます.しかしタウがどのようにして可溶性のモノマーから不溶性の凝集体に変換されるのかはまったく不明でした.まさにこの点が,タウオパチーの病態機序に基づいた根本治療の開発を妨げていました.
米国ペンシルベニア大学の研究者らは,タウオパチーにおけるタウ凝集は年齢に依存して起こることから,タウ凝集を抑制する防御機構が年齢とともに減弱する可能性を考えました.近年,tripartite motif (TRIM)タンパク質が,タンパク質の品質管理(PQC)システムに多面的に関与している可能性が示唆されています.このTRIMはヒトでは77種類存在すると言われていますが,研究チームはこのなかからタウ凝集を減少させる可能性のある3種類を同定しました(TRIM10,TRIM55,TRIM11).実際にAD 23人と対照14人の死後脳を比較すると,AD脳ではTRIM11タンパクレベルのみ大幅に減少していました.またTRIM11遺伝子のレアバリアントがAD発症リスクとなることも報告されていました.
研究チームは,TRIM11が通常のタンパク質品質管理因子とは異なる3つのメカニズムで,タウを可溶状態に維持することを示しています.
①変異型タウや異常リン酸化タウに結合し,SUMO化を促進し,プロテアソーム分解に導く.
②(単に分解するだけでなく)タウの分子シャペロンとして機能し,ミスフォールディングと凝集を回避する.
③TRIM11はタウの脱凝集酵素(disaggregase)であり,タウ凝集体を溶解する.
初代培養神経細胞を用いた検討では,内因性TRIM11の発現抑制は神経細胞の生存率を低下させ,発現増加は生存率とシナプス前・後の点状突起(puncta)の形成を促進することから,TRIM11は重要な神経保護因子とも考えられます.
最後に複数のタウオパチーモデルマウス(タウ変異P301Lを発現するPS19マウスや,アミロイド前駆体タンパクとプレセニリン1を発現する3×Tg-ADマウスなど)を用いて,TRIM11をアデノ随伴ウイルス(AAV)ベクターにより海馬に局所的,あるいは脳脊髄液を通して脳全体に投与したところ,いずれのモデルにおいてもタウ病態と神経炎症は抑制され,認知能力と運動能力も改善しました.つまりタウ変異のみでなく,変異アミロイドβを導入するモデルでも,その下流で生じるTau病理を抑制したことになります.
以上よりTRIM11がタウオパチーに対する重要な保護因子であること,その発現抑制がその病態に関与する可能性があることが示唆されました.よってTRIM11の発現を回復させることが有効な治療戦略になると考えられます.ADのみならず,進行性核上性麻痺や大脳皮質基底核変性症,ピック病などのタウオパチーを一網打尽にできるかもしれません.具体的な治療法として,TRIM11の発現を増加させる遺伝子治療,もしくは小分子が有望と考えられます.
Zhang ZY, et al. TRIM11 protects against tauopathies and is down-regulated in Alzheimer's disease. Science. 2023 Jul 28;381(6656):eadd6696.
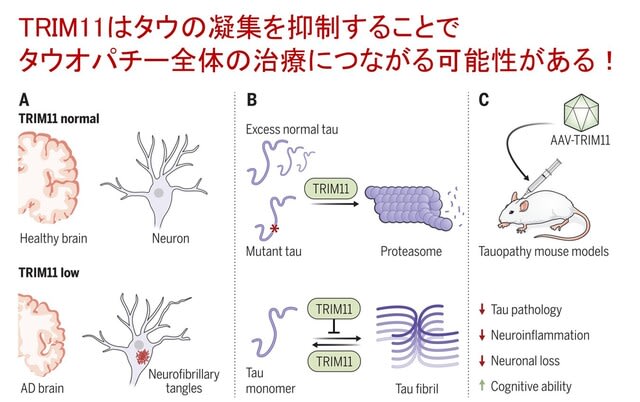
図の説明.(A)TRIM11の発現はタウ凝集を抑制している.発現低下により神経原線維変化が生じる.(B)TRIM11は過剰な正常タウおよび変異タウのプロテアソーム分解を促進する.また分子シャペロンおよび脱凝集酵素としても機能するため,タウの線維化を抑制し,モノマーとしての溶解度を保つ.(C)TRIM11は神経保護作用があり,AAVを介したTRIM11の頭蓋内投与は,複数のタウオパチーモデルマウスを改善する.
米国ペンシルベニア大学の研究者らは,タウオパチーにおけるタウ凝集は年齢に依存して起こることから,タウ凝集を抑制する防御機構が年齢とともに減弱する可能性を考えました.近年,tripartite motif (TRIM)タンパク質が,タンパク質の品質管理(PQC)システムに多面的に関与している可能性が示唆されています.このTRIMはヒトでは77種類存在すると言われていますが,研究チームはこのなかからタウ凝集を減少させる可能性のある3種類を同定しました(TRIM10,TRIM55,TRIM11).実際にAD 23人と対照14人の死後脳を比較すると,AD脳ではTRIM11タンパクレベルのみ大幅に減少していました.またTRIM11遺伝子のレアバリアントがAD発症リスクとなることも報告されていました.
研究チームは,TRIM11が通常のタンパク質品質管理因子とは異なる3つのメカニズムで,タウを可溶状態に維持することを示しています.
①変異型タウや異常リン酸化タウに結合し,SUMO化を促進し,プロテアソーム分解に導く.
②(単に分解するだけでなく)タウの分子シャペロンとして機能し,ミスフォールディングと凝集を回避する.
③TRIM11はタウの脱凝集酵素(disaggregase)であり,タウ凝集体を溶解する.
初代培養神経細胞を用いた検討では,内因性TRIM11の発現抑制は神経細胞の生存率を低下させ,発現増加は生存率とシナプス前・後の点状突起(puncta)の形成を促進することから,TRIM11は重要な神経保護因子とも考えられます.
最後に複数のタウオパチーモデルマウス(タウ変異P301Lを発現するPS19マウスや,アミロイド前駆体タンパクとプレセニリン1を発現する3×Tg-ADマウスなど)を用いて,TRIM11をアデノ随伴ウイルス(AAV)ベクターにより海馬に局所的,あるいは脳脊髄液を通して脳全体に投与したところ,いずれのモデルにおいてもタウ病態と神経炎症は抑制され,認知能力と運動能力も改善しました.つまりタウ変異のみでなく,変異アミロイドβを導入するモデルでも,その下流で生じるTau病理を抑制したことになります.
以上よりTRIM11がタウオパチーに対する重要な保護因子であること,その発現抑制がその病態に関与する可能性があることが示唆されました.よってTRIM11の発現を回復させることが有効な治療戦略になると考えられます.ADのみならず,進行性核上性麻痺や大脳皮質基底核変性症,ピック病などのタウオパチーを一網打尽にできるかもしれません.具体的な治療法として,TRIM11の発現を増加させる遺伝子治療,もしくは小分子が有望と考えられます.
Zhang ZY, et al. TRIM11 protects against tauopathies and is down-regulated in Alzheimer's disease. Science. 2023 Jul 28;381(6656):eadd6696.

図の説明.(A)TRIM11の発現はタウ凝集を抑制している.発現低下により神経原線維変化が生じる.(B)TRIM11は過剰な正常タウおよび変異タウのプロテアソーム分解を促進する.また分子シャペロンおよび脱凝集酵素としても機能するため,タウの線維化を抑制し,モノマーとしての溶解度を保つ.(C)TRIM11は神経保護作用があり,AAVを介したTRIM11の頭蓋内投与は,複数のタウオパチーモデルマウスを改善する.

























