代謝型グルタミン酸受容体(mGluR)は,興奮性神経伝達を媒介するGタンパク質共役型グルタミン酸受容体である.サブタイプが存在し,mGluR1とmGluR5は,主に後シナプスに局在し,活性化によりNMDA受容体活動の増強と興奮毒性を示す.抗mGluR1 抗体は病原性を有し,小脳スライスにおけるプルキンエ細胞機能を変化させることが示されている.また抗mGluR1抗体脳炎では,共通して小脳失調症を示すものの,進行や転帰,治療反応性は個人差があり,予測が難しいと考えられている.今回,その臨床的特徴と予後因子の同定,ならびに抗体がラット海馬ニューロンにおけるmGluR1クラスターにどのような影響をもたらすか検討した論文が報告された.
【患者の特徴】
新規に11名(成人10名,小児1名)が同定され,岐阜大学からの報告(J Neuroimmunol. 2018 Jun 15;319:63-67)も含め,既報の19名と合わせて30名(年齢中央値55歳;43%が女性)が検討された.まず前駆症状(頭痛,体重減少,疲労,吐き気,インフルエンザ様症状など)は,記載のあった17名中7名(41%)で認められ,神経症候よりも30日(以下,数値は中央値)先行していた.主症状は亜急性小脳症候群であり,30名中29名(97%)に認め(動画),発症からピークまでの期間は3ヶ月であったが,7名(23%)では小脳失調が3ヶ月以上進行した(7名の発症からピークまでの期間は19.5ヶ月,四分位範囲8~48ヶ月).また発症からピークまでの期間と抗体検査までの期間には正の相関があり(r = 0.85,p = 0.0001),急性発症の患者では,より早く診断されていた.
【臨床像】
経過中,小脳症候群のみは29名中4名(14%)で,25名(86%)では小脳外徴候を認めた.その内訳としては,認知障害(11/25名,44%),行動変化(6/25名,24%),その他(味覚障害,嚥下障害,自律神経障害,けいれん発作,睡眠障害,運動異常症)であった.行動変化は,過敏性,アパシー,性格変化から,幻覚やカタトニアを伴う精神症状まで多岐にわたった.認知機能障害には,記憶障害,遂行機能障害が含まれていた.運動異常症は5名で認め,ミオクローヌス・ジストニアを特徴としたが,唯一の小児例では顔面・四肢の舞踏病アテトーゼを認めた.けいれん発作は2名でのみで認めた.その他のまれな症状としては,視力低下と運動機能低下があった.3/26名(11%)に腫瘍(ホジキンリンパ腫2名,皮膚T細胞リンパ腫・前立腺腺癌合併)を認めた.
【検査所見】
髄液では19/25名(76%)に異常を認め,細胞数増多を11/25名(44%,27 /mm3),11/20名にオリゴクローナルバンドやIgG index上昇を認めた.脳波は5/8名(62%)で異常があり,焦点性の両側前頭または側頭の徐波化を示し,けいれん発作を起こした1名では間欠期のてんかん放電を認めた.
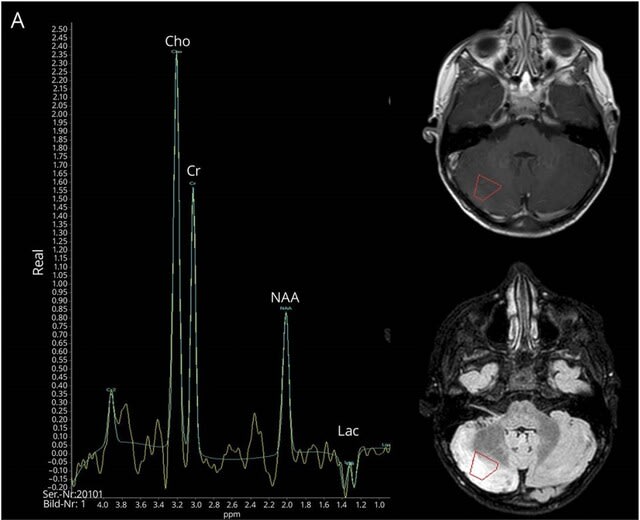
発症時の頭部MRIは7/19名(37%)に異常を認めたが,3名はT2/FLAIRの高信号またはGd造影所見,4名は非特異的な小梗塞様皮質下病変であった.追跡調査では12名中10名(83%)に小脳萎縮が認められた.図Aは6歳男児例.病初期は正常であったが,12日目に右小脳の浮腫を認めた.MRSではNAA/Cr比の低下,Cho/Cr比のわずかな上昇,小脳炎を示唆する乳酸ピークを認めた.
【抗体検査】
発症から9 ヵ月後(IQR 1~25 ヵ月)に実施され,30名全員の血清および 19名の髄液で実施された.両者揃った検体が19名から得られた.うち17 名は血清と髄液の両方で陽性であった.残り1 名は血清のみ,もう1名は髄液のみで陽性であった.
【治療】
30名中25名(83%)が免疫療法(パルス,経口ステロイド,血漿交換,IVIg)を受けた.うち14名(56%)が,シクロホスファミド,リツキシマブ,ミコフェノレートモフェチル,アザチオプリン,タクロリムスのうち1つ以上を含む第2選択免疫療法を受けていた.発症から免疫療法開始までの期間は,発症から抗体検査までの時間と正の相関があった(r = 0.79,p = 0.001).抗体検査の結果が出る前に免疫療法を開始したのは5名のみで,うち4名は急性症状を呈していた(急速進行性でなければ免疫療法が行われにくいことを意味する).
【転帰】
10/25名(40%)では有意な改善または症状の完全な消失がみられたが,13/25名(52%)では臨床的に安定または軽度の改善にとどまった.また残り2名は死亡した(剖検なし).再発は6名で認められたが,すべて免疫療法の中止に伴って生じていた.
最終フォローアップ時(中央値24ヵ月)には,12/16名(75%)にMRI異常があり,10名に小脳萎縮が認められた.ちなみに図B-Dは45歳女性例のもので発症時に認めた右小脳半球のFLAIR高信号(B)は短期間で消失したが,5週間(C)と9年(D)で進行性の小脳萎縮を呈した.

2年後の転帰が不良な群(modified Rankin Scaleスコア>2,7名)は,転帰が良好な群(mRSスコア≦2,12名)と比べ,ピーク時のSARAスコアが高く(中央値29対17),介助歩行も多かった(100%対33%).サンプル数が少なかったためか,両群間で治療の遅延に有意な差はなかった.
【mGluR1抗体のサブクラスと培養ニューロンへの影響】
mGluR1に対する抗体は主にIgG1であり,培養ニューロンにおけるmGluR1クラスターの有意な減少を引き起こした.
【結論】抗mGluR1脳炎は小脳症候群であり,通常は数週間かけてピークに達する亜急性発症であるが,持続的に進行する症例も存在する.通常,成人に発症するが,小児でもまれに発症し,舞踏病アテトーゼといった成人とは異なる症候を呈しうる.発症時の重症度が予後を予測する因子であるが,免疫療法が有効な症例が存在するため,見逃してはならない.
【本論文でも引用されている当科症例のサマリー】
51歳女性,初発症状は歩行障害,構音障害で,約2ヶ月間の経過で進行した.画像上,小脳萎縮は目立たなかった.純粋な小脳性運動失調を呈し,亜急性の経過であったため,傍腫瘍性小脳変性症を含む自己免疫性小脳性運動失調症を念頭において自己抗体の検索を行なった.商業ベースで測定可能な既知の自己抗体(HuD,Yo,Riなど)がすべて陰性であったため,抗mGluR1抗体に対するcell-based assay法による測定系を確立した(患者では図Aの赤い部分のように染色された.図Bは健常対照).さらにラット脳切片を,患者髄液を用いて免疫染色したところ小脳の分子層が染色された(分子層の深層にはプルキンエ細胞が並び,その樹状突起は分子層に存在する).現在も経過観察中であるが,やはり発症時には小脳萎縮は目立たなかったが,5年後には小脳萎縮は顕在化し,SPECTでは小脳血流の低下も認められた.詳細は過去のブロクに記載した.
以上より,純粋小脳失調症(IDCA,従来のCCAないしLCCA)は変性疾患とは限らず,免疫療法の可能性を常に念頭に置く必要がある.
Spatola M et al. Clinical features, prognostic factors, and antibody effects in anti-mGluR1 encephalitis. Neurology Dec 2020, 95 (22) e3012-e3025(doi.org/10.1212/WNL.0000000000010854)
【患者の特徴】
新規に11名(成人10名,小児1名)が同定され,岐阜大学からの報告(J Neuroimmunol. 2018 Jun 15;319:63-67)も含め,既報の19名と合わせて30名(年齢中央値55歳;43%が女性)が検討された.まず前駆症状(頭痛,体重減少,疲労,吐き気,インフルエンザ様症状など)は,記載のあった17名中7名(41%)で認められ,神経症候よりも30日(以下,数値は中央値)先行していた.主症状は亜急性小脳症候群であり,30名中29名(97%)に認め(動画),発症からピークまでの期間は3ヶ月であったが,7名(23%)では小脳失調が3ヶ月以上進行した(7名の発症からピークまでの期間は19.5ヶ月,四分位範囲8~48ヶ月).また発症からピークまでの期間と抗体検査までの期間には正の相関があり(r = 0.85,p = 0.0001),急性発症の患者では,より早く診断されていた.
【臨床像】
経過中,小脳症候群のみは29名中4名(14%)で,25名(86%)では小脳外徴候を認めた.その内訳としては,認知障害(11/25名,44%),行動変化(6/25名,24%),その他(味覚障害,嚥下障害,自律神経障害,けいれん発作,睡眠障害,運動異常症)であった.行動変化は,過敏性,アパシー,性格変化から,幻覚やカタトニアを伴う精神症状まで多岐にわたった.認知機能障害には,記憶障害,遂行機能障害が含まれていた.運動異常症は5名で認め,ミオクローヌス・ジストニアを特徴としたが,唯一の小児例では顔面・四肢の舞踏病アテトーゼを認めた.けいれん発作は2名でのみで認めた.その他のまれな症状としては,視力低下と運動機能低下があった.3/26名(11%)に腫瘍(ホジキンリンパ腫2名,皮膚T細胞リンパ腫・前立腺腺癌合併)を認めた.
【検査所見】
髄液では19/25名(76%)に異常を認め,細胞数増多を11/25名(44%,27 /mm3),11/20名にオリゴクローナルバンドやIgG index上昇を認めた.脳波は5/8名(62%)で異常があり,焦点性の両側前頭または側頭の徐波化を示し,けいれん発作を起こした1名では間欠期のてんかん放電を認めた.
発症時の頭部MRIは7/19名(37%)に異常を認めたが,3名はT2/FLAIRの高信号またはGd造影所見,4名は非特異的な小梗塞様皮質下病変であった.追跡調査では12名中10名(83%)に小脳萎縮が認められた.図Aは6歳男児例.病初期は正常であったが,12日目に右小脳の浮腫を認めた.MRSではNAA/Cr比の低下,Cho/Cr比のわずかな上昇,小脳炎を示唆する乳酸ピークを認めた.

【抗体検査】
発症から9 ヵ月後(IQR 1~25 ヵ月)に実施され,30名全員の血清および 19名の髄液で実施された.両者揃った検体が19名から得られた.うち17 名は血清と髄液の両方で陽性であった.残り1 名は血清のみ,もう1名は髄液のみで陽性であった.
【治療】
30名中25名(83%)が免疫療法(パルス,経口ステロイド,血漿交換,IVIg)を受けた.うち14名(56%)が,シクロホスファミド,リツキシマブ,ミコフェノレートモフェチル,アザチオプリン,タクロリムスのうち1つ以上を含む第2選択免疫療法を受けていた.発症から免疫療法開始までの期間は,発症から抗体検査までの時間と正の相関があった(r = 0.79,p = 0.001).抗体検査の結果が出る前に免疫療法を開始したのは5名のみで,うち4名は急性症状を呈していた(急速進行性でなければ免疫療法が行われにくいことを意味する).
【転帰】
10/25名(40%)では有意な改善または症状の完全な消失がみられたが,13/25名(52%)では臨床的に安定または軽度の改善にとどまった.また残り2名は死亡した(剖検なし).再発は6名で認められたが,すべて免疫療法の中止に伴って生じていた.
最終フォローアップ時(中央値24ヵ月)には,12/16名(75%)にMRI異常があり,10名に小脳萎縮が認められた.ちなみに図B-Dは45歳女性例のもので発症時に認めた右小脳半球のFLAIR高信号(B)は短期間で消失したが,5週間(C)と9年(D)で進行性の小脳萎縮を呈した.

2年後の転帰が不良な群(modified Rankin Scaleスコア>2,7名)は,転帰が良好な群(mRSスコア≦2,12名)と比べ,ピーク時のSARAスコアが高く(中央値29対17),介助歩行も多かった(100%対33%).サンプル数が少なかったためか,両群間で治療の遅延に有意な差はなかった.
【mGluR1抗体のサブクラスと培養ニューロンへの影響】
mGluR1に対する抗体は主にIgG1であり,培養ニューロンにおけるmGluR1クラスターの有意な減少を引き起こした.
【結論】抗mGluR1脳炎は小脳症候群であり,通常は数週間かけてピークに達する亜急性発症であるが,持続的に進行する症例も存在する.通常,成人に発症するが,小児でもまれに発症し,舞踏病アテトーゼといった成人とは異なる症候を呈しうる.発症時の重症度が予後を予測する因子であるが,免疫療法が有効な症例が存在するため,見逃してはならない.
【本論文でも引用されている当科症例のサマリー】
51歳女性,初発症状は歩行障害,構音障害で,約2ヶ月間の経過で進行した.画像上,小脳萎縮は目立たなかった.純粋な小脳性運動失調を呈し,亜急性の経過であったため,傍腫瘍性小脳変性症を含む自己免疫性小脳性運動失調症を念頭において自己抗体の検索を行なった.商業ベースで測定可能な既知の自己抗体(HuD,Yo,Riなど)がすべて陰性であったため,抗mGluR1抗体に対するcell-based assay法による測定系を確立した(患者では図Aの赤い部分のように染色された.図Bは健常対照).さらにラット脳切片を,患者髄液を用いて免疫染色したところ小脳の分子層が染色された(分子層の深層にはプルキンエ細胞が並び,その樹状突起は分子層に存在する).現在も経過観察中であるが,やはり発症時には小脳萎縮は目立たなかったが,5年後には小脳萎縮は顕在化し,SPECTでは小脳血流の低下も認められた.詳細は過去のブロクに記載した.
以上より,純粋小脳失調症(IDCA,従来のCCAないしLCCA)は変性疾患とは限らず,免疫療法の可能性を常に念頭に置く必要がある.
Spatola M et al. Clinical features, prognostic factors, and antibody effects in anti-mGluR1 encephalitis. Neurology Dec 2020, 95 (22) e3012-e3025(doi.org/10.1212/WNL.0000000000010854)

























