アルツハイマー病(AD)におけるアミロイドβ(Aβ)を標的とした免疫療法が注目され,Aβを除去することで病態の進行を遅らせることが期待されています.しかしそのメカニズムや影響については未解明な部分が多く残されています.Nature Medicine誌に,米国ノースウェスタン大学の研究チームが,免疫療法を行ったヒト剖検脳の変化を詳細に解析した研究を報告しました.かなり驚きの論文で,治療に関わる人は認識しておくべき論文だと思います. 剖検脳を使うものの,従来の病理学とはまったく異なる趣のFigureが続く論文です.しかし結論は比較的シンプルで,ワクチンや抗体薬はミクログリアを活性化してAβを除去するものの,同時に補体系の持続的な活性化,神経炎症,鉄代謝の変化も生じ,かつタウ病理は抑制されないということを述べています.
対象はAN1792ワクチン(能動免疫)試験に参加した13例(Aβ除去が広範な群と,限定的な群に分ける)と,レカネマブ(受動免疫)投与後に死亡した65歳女性(ε4/ε4ホモ.レカネマブ3回投与後脳出血で死亡.tPA使用)の1例の剖検脳,そして対照(疾患対照6例,健常対照6例)です.Aβ除去による脳内変化を比較しました.レカネマブは1例だけなのでどこまで分かるのだろうと思いましたが,空間トランスクリプトミクスとシングルセルRNAシーケンスを用いると,ここまでできるのかと驚きました.
【Aβ除去はミクログリア・マクロファージにより行われる】
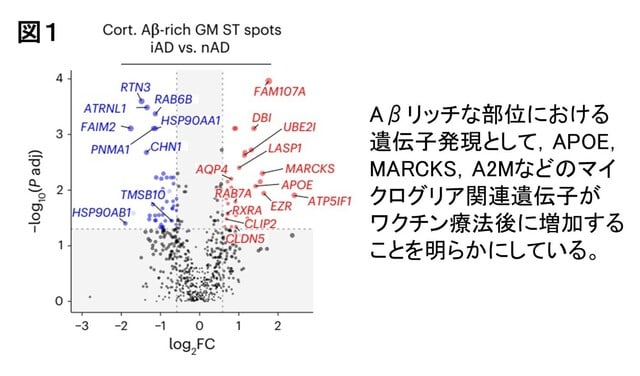
AN1792ワクチン接種した脳では,Aβプラークの周囲で,炎症性ミクログリアの活性化の持続が認められました.具体的には,Aβ除去が進むと,TREM2(ミクログリアの活性化を制御する受容体)を発現するミクログリアが活性化すること,またAβの代謝や除去に関わるAPOEの発現も亢進し,APOEを介したAβ除去が行われることが示唆されました(図1).これらはAβを除去するためのミクログリアの変化と考えられました.
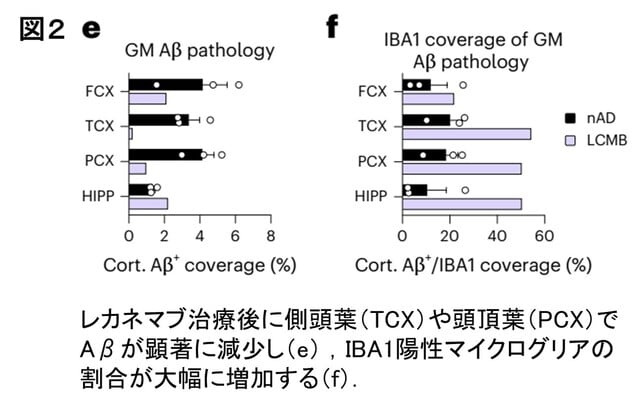
一方,レカネマブ治療後の1例では,側頭葉や頭頂葉でAβが顕著に減少し,レカネマブがAβクリアランスを促進していました(図2e).そのかわりIBA1陽性マイクログリアの被覆率(coverage)が約44%に増加し,対照群(nAD)の約15%よりも顕著に高くなっていました(図2f).つまりレカネマブはマイクログリアの活性化を促し,Aβ貪食を強化することでAβを減少させることが示唆されました.
つぎにレカネマブ治療の有無によるミクログリアとマクロファージの遺伝子発現の違いを検討しています.レカネマブ群ではSPP1(オステオポンチン)やAPOC1(アポリポタンパクC1)が上昇し,Aβクリアランスや炎症調節に関与していることが示唆されました.TREM2,APOE,CD68(マクロファージや単球マーカー)など,貪食活性関連遺伝子が上昇し,Aβ除去を促進する可能性が示唆されました.よってレカネマブは,マイクログリア・マクロファージのAβ処理機能を変化させることを示しています(図3j).

またSPP1やAPOC1は組織修復を示唆するマーカーで,炎症(Aβの貪食)から組織修復にシフトするものと考えられました.図4hは,レカネマブ治療後の海馬におけるCD68(マクロファージ), IBA1(マイクログリア)がAβプラーク周囲に集積し,貪食している様子を示しています.

【Aβ除去に伴い補体系が活性化する】
AN1792ワクチン接種後のAβリッチな領域における遺伝子発現として,特に補体系(C3)や炎症性サイトカイン(IL6-JAK-STAT3)の活性化が確認されています(図5p).同様にレカネマブ投与後の遺伝子発現でも,補体系(C3)やIL-2–STAT5シグナルの調節異常が確認され,特に炎症関連遺伝子の発現が上昇していることが分かりました.つまりワクチンやレカネマブは,Aβクリアランスを促進する一方で,免疫細胞の活性化を伴う可能性を示唆しています(図5k).またレカネマブ投与例ではARIAに関連する組織球性血管炎(histiocytic vasculitis)を認めました.

【Aβを除去してもタウ病理は持続する】
能動免疫も受動免疫も,大幅なAβ除去にもかかわらずタウ病理が持続していることが示されました.Aβの蓄積が減少しても,タウの異常リン酸化が持続し,神経細胞の機能低下に関与する可能性があります.
【ミクログリアの鉄代謝は変化する】
レカネマブ治療後のミクログリアでは鉄代謝関連遺伝子(FTH1,FTL)が活性化し,酸化ストレスとの関連が示唆されました.またやインターフェロン応答遺伝子(IFI6)が顕著に増加しており,神経炎症の促進が生じている可能性があります.
【考察】
以上のように,Aβ除去に伴い脳内環境に大きな変化,つまりミクログリアの活性化や補体系の持続的な活性化,タウ病理の持続,鉄代謝の変化が生じていることが明らかになりました.現在,抗体療法後の脳萎縮をどのように考えるかでホットな議論がなされていますが,そのなかの一つの説である「脳萎縮は,Aβが減ったことにより生じる」というような単純な説(アミロイド除去に伴う偽萎縮)は否定して良いように思います.この論文では,脳萎縮との関連は議論していないものの,補体シグナルの過剰な活性化がシナプスを除去したり,神経炎症が神経細胞のアポトーシスを誘導したり,タウリン酸化が進んで変性が進んだり,病的な脳萎縮の進行を促す可能性があるのではないかと思いました.抗体療法によるAβ除去は,アルツハイマー病治療における重要な一歩ですが,光と影の両面があるということを示す論文だと思います.
Gate, D., et al. "Microglial mechanisms drive amyloid-β clearance in immunized patients with Alzheimer’s disease." Nature Medicine, 2025. https://doi.org/10.1038/s41591-025-03574-1.
対象はAN1792ワクチン(能動免疫)試験に参加した13例(Aβ除去が広範な群と,限定的な群に分ける)と,レカネマブ(受動免疫)投与後に死亡した65歳女性(ε4/ε4ホモ.レカネマブ3回投与後脳出血で死亡.tPA使用)の1例の剖検脳,そして対照(疾患対照6例,健常対照6例)です.Aβ除去による脳内変化を比較しました.レカネマブは1例だけなのでどこまで分かるのだろうと思いましたが,空間トランスクリプトミクスとシングルセルRNAシーケンスを用いると,ここまでできるのかと驚きました.
【Aβ除去はミクログリア・マクロファージにより行われる】
AN1792ワクチン接種した脳では,Aβプラークの周囲で,炎症性ミクログリアの活性化の持続が認められました.具体的には,Aβ除去が進むと,TREM2(ミクログリアの活性化を制御する受容体)を発現するミクログリアが活性化すること,またAβの代謝や除去に関わるAPOEの発現も亢進し,APOEを介したAβ除去が行われることが示唆されました(図1).これらはAβを除去するためのミクログリアの変化と考えられました.

一方,レカネマブ治療後の1例では,側頭葉や頭頂葉でAβが顕著に減少し,レカネマブがAβクリアランスを促進していました(図2e).そのかわりIBA1陽性マイクログリアの被覆率(coverage)が約44%に増加し,対照群(nAD)の約15%よりも顕著に高くなっていました(図2f).つまりレカネマブはマイクログリアの活性化を促し,Aβ貪食を強化することでAβを減少させることが示唆されました.

つぎにレカネマブ治療の有無によるミクログリアとマクロファージの遺伝子発現の違いを検討しています.レカネマブ群ではSPP1(オステオポンチン)やAPOC1(アポリポタンパクC1)が上昇し,Aβクリアランスや炎症調節に関与していることが示唆されました.TREM2,APOE,CD68(マクロファージや単球マーカー)など,貪食活性関連遺伝子が上昇し,Aβ除去を促進する可能性が示唆されました.よってレカネマブは,マイクログリア・マクロファージのAβ処理機能を変化させることを示しています(図3j).

またSPP1やAPOC1は組織修復を示唆するマーカーで,炎症(Aβの貪食)から組織修復にシフトするものと考えられました.図4hは,レカネマブ治療後の海馬におけるCD68(マクロファージ), IBA1(マイクログリア)がAβプラーク周囲に集積し,貪食している様子を示しています.

【Aβ除去に伴い補体系が活性化する】
AN1792ワクチン接種後のAβリッチな領域における遺伝子発現として,特に補体系(C3)や炎症性サイトカイン(IL6-JAK-STAT3)の活性化が確認されています(図5p).同様にレカネマブ投与後の遺伝子発現でも,補体系(C3)やIL-2–STAT5シグナルの調節異常が確認され,特に炎症関連遺伝子の発現が上昇していることが分かりました.つまりワクチンやレカネマブは,Aβクリアランスを促進する一方で,免疫細胞の活性化を伴う可能性を示唆しています(図5k).またレカネマブ投与例ではARIAに関連する組織球性血管炎(histiocytic vasculitis)を認めました.

【Aβを除去してもタウ病理は持続する】
能動免疫も受動免疫も,大幅なAβ除去にもかかわらずタウ病理が持続していることが示されました.Aβの蓄積が減少しても,タウの異常リン酸化が持続し,神経細胞の機能低下に関与する可能性があります.
【ミクログリアの鉄代謝は変化する】
レカネマブ治療後のミクログリアでは鉄代謝関連遺伝子(FTH1,FTL)が活性化し,酸化ストレスとの関連が示唆されました.またやインターフェロン応答遺伝子(IFI6)が顕著に増加しており,神経炎症の促進が生じている可能性があります.
【考察】
以上のように,Aβ除去に伴い脳内環境に大きな変化,つまりミクログリアの活性化や補体系の持続的な活性化,タウ病理の持続,鉄代謝の変化が生じていることが明らかになりました.現在,抗体療法後の脳萎縮をどのように考えるかでホットな議論がなされていますが,そのなかの一つの説である「脳萎縮は,Aβが減ったことにより生じる」というような単純な説(アミロイド除去に伴う偽萎縮)は否定して良いように思います.この論文では,脳萎縮との関連は議論していないものの,補体シグナルの過剰な活性化がシナプスを除去したり,神経炎症が神経細胞のアポトーシスを誘導したり,タウリン酸化が進んで変性が進んだり,病的な脳萎縮の進行を促す可能性があるのではないかと思いました.抗体療法によるAβ除去は,アルツハイマー病治療における重要な一歩ですが,光と影の両面があるということを示す論文だと思います.
Gate, D., et al. "Microglial mechanisms drive amyloid-β clearance in immunized patients with Alzheimer’s disease." Nature Medicine, 2025. https://doi.org/10.1038/s41591-025-03574-1.

























