今回のキーワードは,ファイザーワクチンのオミクロン株亜型に対する入院予防効果は3~4カ月で低下する,モデルナ二価ブースター・ワクチンはオミクロン株に対する中和抗体反応を起こし,明らかな安全性の懸念はない,二価ワクチンの最新情報についての米国医師会インタビュー,ウイルスの持続感染の機序「体内リザーバー」を解明し,Long COVID治療薬の臨床試験を取り仕切る国際的組織LCRIが発足した,です.
新しいワクチンが話題ですが,オミクロン株亜型BA.4/BA.5に対するワクチンの臨床試験論文を目にしないまま接種開始が間近に迫っているため「どういうことだろう?」と思っていました.米国医師会(AMA)のワクチン担当者のインタビュー動画を見て,ある程度,理解ができました.今回の内容をまとめると,オミクロン株亜型に対する従来ワクチンの「重症化予防効果」は4ヶ月程度で急激に低下してしまうこと,対抗策として「二価ワクチン(ワクチンに含まれるウイルスの種類が2つ)」が作られたこと,当初,BA.1を標的に作り,中和抗体の評価や安全性の確認が行われたが,流行がBA.4とBA.5に変わってしまい,FDAがメーカーにワクチンを作り変えるよう指示したことが分かりました.BA.4とBA.5に対する「重症化予防効果」を含むデータは今後,明らかになるものと思います.個人的には納得して二価ワクチンを打ちます.それにしてWHOテドロス事務局長がパンデミックの「終わりが視野に入ってきた」と発言したそうですが,どういう出口を考えているのか理解できないです.
◆ファイザーワクチンのオミクロン株亜型に対する入院予防効果は3~4カ月で低下する.
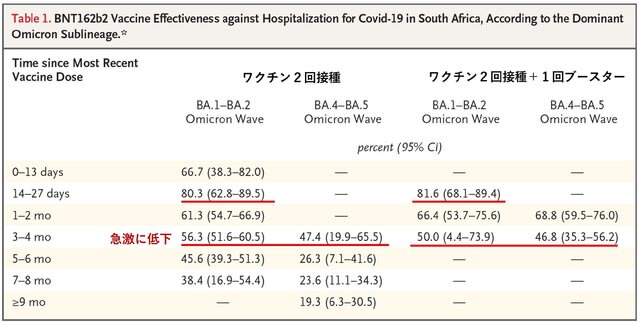
南アフリカで370万人に医療保険を提供する医療機関の会員を対象に,オミクロン株亜型に対するBNT162b2(ファイザー・ビオンテック)ワクチンの有効性と持続性を評価した研究が報告された.2021年11月から2022年6月までの期間に,診療のために入院していた3万2883人の患者が対象となった. PCR検査で5909人(18.0%)が陽性であった.この集団において,BA.1/BA.2が優勢であった時期(2021年11月から2022年2月),BA.4/BA.5が優勢であった時期(2022年4月から6月)において,ファイザーワクチンの2回接種および3回接種(2回+ブースター)の有効性を,COVIDによる入院の予防効果により評価した.結果は,2回および3回のいずれでも,接種後3~4カ月で入院に対する予防効果の減弱がみられた.2回接種ではBA.1-BA.2期間で56.3%,BA.4-BA.5期間で47.4%まで低下し,3回接種でもBA.1-BA.2期間で50.0%,BA.4-BA.5期間で46.8%と,3~4カ月で低下していた(図1).以上より,ファイザーワクチンの2回または3回接種では,オミクロン株亜型による入院に対する予防効果が急速に低下することが分かった.最終接種後4カ月という早い時期にブースト接種する必要があること,もしくは予防効果を維持するために亜型を取り入れたワクチンが必要であると考えられた.
New Engl J Med. Sep 14, 2022(doi/org/10.1056/NEJMc2210093)
◆モデルナ二価ブースター・ワクチンはオミクロン株に対する中和抗体反応を起こし,明らかな安全性の懸念はない.
ワクチンの「価数」は,ワクチンに含まれるウイルスの種類の数を表す.オミクロン株を含む二価のモデルナ・ブースター・ワクチン(mRNA-1273.214)の安全性と免疫原性についての論文(中間報告)が発表された.現在進行中のこの第 2―3相試験では,50μg の二価ワクチン mRNA-1273.214(オリジナルのWuhan-Hu-1 と オミクロンB.1.1.529 [つまりBA.1]スパイク蛋白メッセンジャーRNAをそれぞれ 25μg)と,50μgのmRNA-1273(つまり従来のモデルナワクチン)のブースター効果が比較された.具体的には,最初に2回接種(100μg)し,1 回のブースター接種(50μg)を受けた成人(3 ヶ月以上前)を対象に,2度めのブースターとしてmRNA-1273.214またmRNA-1273を接種した.評価項目は,ブースター接種後 28 日目における安全性,反応原性(副反応),免疫原性である.
二価モデルナを 437 人,従来モデルナを377 人に接種した.最終接種からの期間(中央値)は,二価モデルナは136日,従来モデルナは134日であった.感染歴のない人では,BA.1株に対する中和抗体の幾何平均力価は二価モデルナ接種後で2372.4,従来モデルナ接種後で1473.5であった(図2).さらにBA.4/BA.5に対しては,それぞれ727.4および492.1であった.さらに二価モデルナは従来モデルナよりも,他の複数の変異株(アルファ,ベータ,ガンマ,デルタ)に対して高い結合抗体反応を示した.安全性と副反応は,2つのブースター・ワクチンで同様であった.この試験では,ワクチンの有効性は評価されなかった.探索的解析では二価ワクチン接種後に11人,従来ワクチン接種後に9人が感染している.以上より,2価のモデルナ・ブースター・ワクチンmRNA-1273.214 は,オミクロン株に対する中和抗体反応を起こし,従来のモデルナワクチンよりも優れていた.明らかな安全性の懸念はなかった.
New Engl J Med. Sep 16, 2022(doi.org/10.1056/NEJMoa2208343)

◆二価ワクチンの最新情報についての米国医師会インタビュー(オミクロン特異的二価ワクチンはBA.1を標的にしたものをBA.4,BA.5のスパイク蛋白を標的としたワクチンに作り変えたものである)
米国医師会(American Medical Association:AMA)のホームページ(https://bit.ly/3QTEZVg)に,FDAが認可した2つの二価ブースター・ワクチン(モデルナとファイザー・ビオンテック)について,AMA評議員会議長でCDC予防接種実施諮問委員会(ACIP)へのリエゾンであるSandra Fryhofer先生のインタビューが公開されている(公開日付は9月8日;図3).以下,要点をまとめたい.
「二価」とは,半分がオリジナル株で,半分がオミクロンBA.4,BA.5であることを意味する.ACIPは現在,12歳以上のすべての人にこの二価ワクチンを推奨している.過去にCOVIDワクチンを接種していたとしても,ブースター接種をすべきである,
ファイザーの2価ワクチンは,12歳以上で,モデルナは18歳以上で接種が認められる.一次接種を受けた5~11歳の子どもは,オリジナルの一価ブースターを受けてほしい.COVIDワクチンの一次接種を済ませていることが接種の条件である.
接種のタイミングは,前回から最低でも2ヶ月は必要.ほとんどの人は6ヶ月以上となるだろう.ただし感染後は,CDCのガイダンスに従い,少なくとも3ヶ月は接種を待った方がよい.
BA.4とBA.5は異なるオミクロン株の亜種で,異なる変異を持つが,スパイクタンパク質は偶然にも同じものであるため,この新しい二価ワクチンはBA.4とBA.5の両方をターゲットにしている.
オミクロン特異的二価ワクチンは,1400人以上を対象に研究されたが,ヒトでの臨床研究はBA.1を対象として行われた.しかしもうBA.1は流行していない.そこでFDAは,BA.4,BA.5のスパイク蛋白を標的としたワクチンに作り変えるようメーカーに指示した.このようなワクチンの標的株を変更することは新しいことではなく,インフルエンザ・ワクチンでは毎年行っている.今年のインフルエンザの季節に,昨年のインフルエンザ・ワクチンを接種することはない.FDAは,完全な臨床試験を必要とせずに,インフルエンザウイルスの変異に伴うインフルエンザ・ワクチンの変更を許可している.これと同じことである.つまりBA.4とBA.5のブースター効果は動物では研究されているが,ヒトでの臨床試験データはまだない.しかしいずれは出てくるだろう.
BA.1二価ワクチン臨床試験では,オリジナルに2つ目の変異株を追加することで,抗体反応の幅が広がることが分かった.オミクロン株だけでなく,他の変異株に対しても,高い抗体価が得られた.感染したことのある人に二価のCOVIDワクチンを投与したところ,最も高い抗体価が得られた.
副反応は従来の他のワクチンと同様であった.心筋炎や心膜炎はなかった.疲労,頭痛,筋痛,関節痛,悪寒,吐き気,嘔吐,そして発熱である.BA.1とBA.4, BA.5のスパイクタンパク質の配列には微妙な違いがあるものの,専門家は安全性や副反応に違いはないと予想している.
インフルエンザと二価ワクチンの予防接種を同時に受けることは問題なく,むしろCDCはそれを奨励している.
保管のルールは,従来ワクチン製品と同じであるが,残念なことに,ラベルの色分けなどは紛らわしく,誤解を招きやすいので注意が必要.
重篤な合併症,入院,死亡からあなたとあなたの大切な人を守るために,ブースター接種を含め,COVIDワクチンについて最新の情報を得ることを強く勧める.

◆ウイルスの持続感染の機序「体内リザーバー」を解明し,Long COVID治療薬の臨床試験を取り仕切る国際的組織LCRIが発足した.
すでに1億5000万人を数え,増加を続けるLong COVIDを研究し,治療薬候補の臨床試験を取り仕切る国際的組織Long Covid Research Initiative (LCRI) が,9月8日に設立された.Long COVIDではウイルスは組織内に留まり,免疫系を刺激し続けている可能性がある.このため,その下流の出来事として,血液凝固,神経炎症など,さまざまな影響を引き起こすものと考えられる.SARS-CoV-2ウイルスが組織内に持続することは「ウイルスリザーバー」と呼ばれる.LCRIはこの現象,すなわち「ウイルス持続感染がlong COVIDの原因である」という研究仮説を立てた(図4).LCRIは以下のように研究と治療法の2つのアプローチを行う仮想研究機関と言える.
①LCRI研究プログラム:世界トップクラスの研究機関の科学者が専門知識を結集し,病態機序を研究する.「ウイルスリザーバー」を明らかにするための組織生検研究,剖検と画像研究(全身と脳),血液ベースのバイオマーカー研究,下流への影響の研究, 他の病原体やマイクロバイオームへの影響の研究(ヘルペスウイルスやトキソプラズマなど他の潜伏病原体の再活性化がどの程度促進されるか等)が行われる.
②LCRI臨床試験プログラム:研究プログラムの成果を治療標的に変換し,臨床試験で用いる.
研究プログラムの成果を基に,LCRIが臨床試験を開始する治療薬のパイプラインを特定する.候補となる治療薬には,抗ウイルス剤,免疫調節剤,抗凝固剤,マイクロバイオーム治療薬などがある.
ハーバード大学,スタンフォード大学,UCSF,ジョンズ・ホプキンス大学,ペンシルバニア大学,マウントサイナイ大学,イェール大学等の科学者と臨床医が参加する.科学投資ファンドBalviが1500万ドルを寄付する.慈善団体による支援も広がっている.科学者,慈善家,製薬会社,患者コミュニティといった多様なステークホルダーが世界的な連携を構築することで,研究と臨床試験の両方を急発進させる.
→ Long COVIDに対する研究者や支援者の多さに米国の凄さを改めて感じた.
新しいワクチンが話題ですが,オミクロン株亜型BA.4/BA.5に対するワクチンの臨床試験論文を目にしないまま接種開始が間近に迫っているため「どういうことだろう?」と思っていました.米国医師会(AMA)のワクチン担当者のインタビュー動画を見て,ある程度,理解ができました.今回の内容をまとめると,オミクロン株亜型に対する従来ワクチンの「重症化予防効果」は4ヶ月程度で急激に低下してしまうこと,対抗策として「二価ワクチン(ワクチンに含まれるウイルスの種類が2つ)」が作られたこと,当初,BA.1を標的に作り,中和抗体の評価や安全性の確認が行われたが,流行がBA.4とBA.5に変わってしまい,FDAがメーカーにワクチンを作り変えるよう指示したことが分かりました.BA.4とBA.5に対する「重症化予防効果」を含むデータは今後,明らかになるものと思います.個人的には納得して二価ワクチンを打ちます.それにしてWHOテドロス事務局長がパンデミックの「終わりが視野に入ってきた」と発言したそうですが,どういう出口を考えているのか理解できないです.
◆ファイザーワクチンのオミクロン株亜型に対する入院予防効果は3~4カ月で低下する.
南アフリカで370万人に医療保険を提供する医療機関の会員を対象に,オミクロン株亜型に対するBNT162b2(ファイザー・ビオンテック)ワクチンの有効性と持続性を評価した研究が報告された.2021年11月から2022年6月までの期間に,診療のために入院していた3万2883人の患者が対象となった. PCR検査で5909人(18.0%)が陽性であった.この集団において,BA.1/BA.2が優勢であった時期(2021年11月から2022年2月),BA.4/BA.5が優勢であった時期(2022年4月から6月)において,ファイザーワクチンの2回接種および3回接種(2回+ブースター)の有効性を,COVIDによる入院の予防効果により評価した.結果は,2回および3回のいずれでも,接種後3~4カ月で入院に対する予防効果の減弱がみられた.2回接種ではBA.1-BA.2期間で56.3%,BA.4-BA.5期間で47.4%まで低下し,3回接種でもBA.1-BA.2期間で50.0%,BA.4-BA.5期間で46.8%と,3~4カ月で低下していた(図1).以上より,ファイザーワクチンの2回または3回接種では,オミクロン株亜型による入院に対する予防効果が急速に低下することが分かった.最終接種後4カ月という早い時期にブースト接種する必要があること,もしくは予防効果を維持するために亜型を取り入れたワクチンが必要であると考えられた.
New Engl J Med. Sep 14, 2022(doi/org/10.1056/NEJMc2210093)

◆モデルナ二価ブースター・ワクチンはオミクロン株に対する中和抗体反応を起こし,明らかな安全性の懸念はない.
ワクチンの「価数」は,ワクチンに含まれるウイルスの種類の数を表す.オミクロン株を含む二価のモデルナ・ブースター・ワクチン(mRNA-1273.214)の安全性と免疫原性についての論文(中間報告)が発表された.現在進行中のこの第 2―3相試験では,50μg の二価ワクチン mRNA-1273.214(オリジナルのWuhan-Hu-1 と オミクロンB.1.1.529 [つまりBA.1]スパイク蛋白メッセンジャーRNAをそれぞれ 25μg)と,50μgのmRNA-1273(つまり従来のモデルナワクチン)のブースター効果が比較された.具体的には,最初に2回接種(100μg)し,1 回のブースター接種(50μg)を受けた成人(3 ヶ月以上前)を対象に,2度めのブースターとしてmRNA-1273.214またmRNA-1273を接種した.評価項目は,ブースター接種後 28 日目における安全性,反応原性(副反応),免疫原性である.
二価モデルナを 437 人,従来モデルナを377 人に接種した.最終接種からの期間(中央値)は,二価モデルナは136日,従来モデルナは134日であった.感染歴のない人では,BA.1株に対する中和抗体の幾何平均力価は二価モデルナ接種後で2372.4,従来モデルナ接種後で1473.5であった(図2).さらにBA.4/BA.5に対しては,それぞれ727.4および492.1であった.さらに二価モデルナは従来モデルナよりも,他の複数の変異株(アルファ,ベータ,ガンマ,デルタ)に対して高い結合抗体反応を示した.安全性と副反応は,2つのブースター・ワクチンで同様であった.この試験では,ワクチンの有効性は評価されなかった.探索的解析では二価ワクチン接種後に11人,従来ワクチン接種後に9人が感染している.以上より,2価のモデルナ・ブースター・ワクチンmRNA-1273.214 は,オミクロン株に対する中和抗体反応を起こし,従来のモデルナワクチンよりも優れていた.明らかな安全性の懸念はなかった.
New Engl J Med. Sep 16, 2022(doi.org/10.1056/NEJMoa2208343)

◆二価ワクチンの最新情報についての米国医師会インタビュー(オミクロン特異的二価ワクチンはBA.1を標的にしたものをBA.4,BA.5のスパイク蛋白を標的としたワクチンに作り変えたものである)
米国医師会(American Medical Association:AMA)のホームページ(https://bit.ly/3QTEZVg)に,FDAが認可した2つの二価ブースター・ワクチン(モデルナとファイザー・ビオンテック)について,AMA評議員会議長でCDC予防接種実施諮問委員会(ACIP)へのリエゾンであるSandra Fryhofer先生のインタビューが公開されている(公開日付は9月8日;図3).以下,要点をまとめたい.
「二価」とは,半分がオリジナル株で,半分がオミクロンBA.4,BA.5であることを意味する.ACIPは現在,12歳以上のすべての人にこの二価ワクチンを推奨している.過去にCOVIDワクチンを接種していたとしても,ブースター接種をすべきである,
ファイザーの2価ワクチンは,12歳以上で,モデルナは18歳以上で接種が認められる.一次接種を受けた5~11歳の子どもは,オリジナルの一価ブースターを受けてほしい.COVIDワクチンの一次接種を済ませていることが接種の条件である.
接種のタイミングは,前回から最低でも2ヶ月は必要.ほとんどの人は6ヶ月以上となるだろう.ただし感染後は,CDCのガイダンスに従い,少なくとも3ヶ月は接種を待った方がよい.
BA.4とBA.5は異なるオミクロン株の亜種で,異なる変異を持つが,スパイクタンパク質は偶然にも同じものであるため,この新しい二価ワクチンはBA.4とBA.5の両方をターゲットにしている.
オミクロン特異的二価ワクチンは,1400人以上を対象に研究されたが,ヒトでの臨床研究はBA.1を対象として行われた.しかしもうBA.1は流行していない.そこでFDAは,BA.4,BA.5のスパイク蛋白を標的としたワクチンに作り変えるようメーカーに指示した.このようなワクチンの標的株を変更することは新しいことではなく,インフルエンザ・ワクチンでは毎年行っている.今年のインフルエンザの季節に,昨年のインフルエンザ・ワクチンを接種することはない.FDAは,完全な臨床試験を必要とせずに,インフルエンザウイルスの変異に伴うインフルエンザ・ワクチンの変更を許可している.これと同じことである.つまりBA.4とBA.5のブースター効果は動物では研究されているが,ヒトでの臨床試験データはまだない.しかしいずれは出てくるだろう.
BA.1二価ワクチン臨床試験では,オリジナルに2つ目の変異株を追加することで,抗体反応の幅が広がることが分かった.オミクロン株だけでなく,他の変異株に対しても,高い抗体価が得られた.感染したことのある人に二価のCOVIDワクチンを投与したところ,最も高い抗体価が得られた.
副反応は従来の他のワクチンと同様であった.心筋炎や心膜炎はなかった.疲労,頭痛,筋痛,関節痛,悪寒,吐き気,嘔吐,そして発熱である.BA.1とBA.4, BA.5のスパイクタンパク質の配列には微妙な違いがあるものの,専門家は安全性や副反応に違いはないと予想している.
インフルエンザと二価ワクチンの予防接種を同時に受けることは問題なく,むしろCDCはそれを奨励している.
保管のルールは,従来ワクチン製品と同じであるが,残念なことに,ラベルの色分けなどは紛らわしく,誤解を招きやすいので注意が必要.
重篤な合併症,入院,死亡からあなたとあなたの大切な人を守るために,ブースター接種を含め,COVIDワクチンについて最新の情報を得ることを強く勧める.

◆ウイルスの持続感染の機序「体内リザーバー」を解明し,Long COVID治療薬の臨床試験を取り仕切る国際的組織LCRIが発足した.
すでに1億5000万人を数え,増加を続けるLong COVIDを研究し,治療薬候補の臨床試験を取り仕切る国際的組織Long Covid Research Initiative (LCRI) が,9月8日に設立された.Long COVIDではウイルスは組織内に留まり,免疫系を刺激し続けている可能性がある.このため,その下流の出来事として,血液凝固,神経炎症など,さまざまな影響を引き起こすものと考えられる.SARS-CoV-2ウイルスが組織内に持続することは「ウイルスリザーバー」と呼ばれる.LCRIはこの現象,すなわち「ウイルス持続感染がlong COVIDの原因である」という研究仮説を立てた(図4).LCRIは以下のように研究と治療法の2つのアプローチを行う仮想研究機関と言える.

①LCRI研究プログラム:世界トップクラスの研究機関の科学者が専門知識を結集し,病態機序を研究する.「ウイルスリザーバー」を明らかにするための組織生検研究,剖検と画像研究(全身と脳),血液ベースのバイオマーカー研究,下流への影響の研究, 他の病原体やマイクロバイオームへの影響の研究(ヘルペスウイルスやトキソプラズマなど他の潜伏病原体の再活性化がどの程度促進されるか等)が行われる.
②LCRI臨床試験プログラム:研究プログラムの成果を治療標的に変換し,臨床試験で用いる.
研究プログラムの成果を基に,LCRIが臨床試験を開始する治療薬のパイプラインを特定する.候補となる治療薬には,抗ウイルス剤,免疫調節剤,抗凝固剤,マイクロバイオーム治療薬などがある.
ハーバード大学,スタンフォード大学,UCSF,ジョンズ・ホプキンス大学,ペンシルバニア大学,マウントサイナイ大学,イェール大学等の科学者と臨床医が参加する.科学投資ファンドBalviが1500万ドルを寄付する.慈善団体による支援も広がっている.科学者,慈善家,製薬会社,患者コミュニティといった多様なステークホルダーが世界的な連携を構築することで,研究と臨床試験の両方を急発進させる.
→ Long COVIDに対する研究者や支援者の多さに米国の凄さを改めて感じた.

























