Neurology Clinical Practice誌のFive new thingsは,新しい知識を学ぶのに良い連載であるが,今月号ではハンチントン病以外の舞踏運動を取り上げている.原疾患の診断により治療が可能なことが少なからずあるため,鑑別診断が重要となる.さらにこのテーマは,Huntington's Disease-like 2やBenign hereditary chorea(BHC2)など大学院時代から取り組んできたものでもあり個人的にも関心が深い.
Margolis RL et al. Huntington's Disease-like 2 (HDL2) in North America and Japan. Ann Neurol. 2004 Nov;56(5):670-4.
Shimohata T et al. Novel locus for benign hereditary chorea with adult onset maps to chromosome 8q21.3 q23.3. Brain. 2007 Sep;130(Pt 9):2302-9.
下畑享良ら.舞踏運動の鑑別診断.脳と神経 61(8), 963-971, 2009
ではFive new thingsをまとめたい.
【ADCY5関連ジスキネジア】
adenylate cyclase 5(ADCY5)遺伝子変異は小児期発症の舞踏運動の原因となる(常染色体優性ないしde novo変異).表現型としては発作性舞踏運動(とくに夜間に増悪),ジストニア,ミオクローヌス,低トーヌスを示す.経時的な進行は目立たない.家族性良性舞踏病の原因のひとつと言える.治療としてベンゾジアゼピンが有効.またADCY5は線条体や心筋に高発現するため,最初のレポートの家系では心筋症や心不全が認められた.YouTubeにて動画を見ることができる.
ADCY5-related dyskinesia
【C9ORF72遺伝子変異】
C9ORF72の6塩基反復配列(GGGGCC)の異常伸長は,常染色体優性遺伝形式を示し,ALSや前頭側頭型認知症以外に,ハンチントン病様症状を示す.これらの種々の表現型が同一家系内でも認められることがあるが,その機序は不明である.健常者は2-20リピート程度,それ以上から200~300リポートがintermediate,それ以上から数千までが発症者になる.発症は小児にも見られるが,多くは成年期以降である.上位運動ニューロン徴候や前頭葉徴候がヒントとなる.病理所見はTDP43-opathyであるが,基底核にとくに病理変化が強いかは不明である.
【脳内鉄蓄積を伴う神経変性症候群】
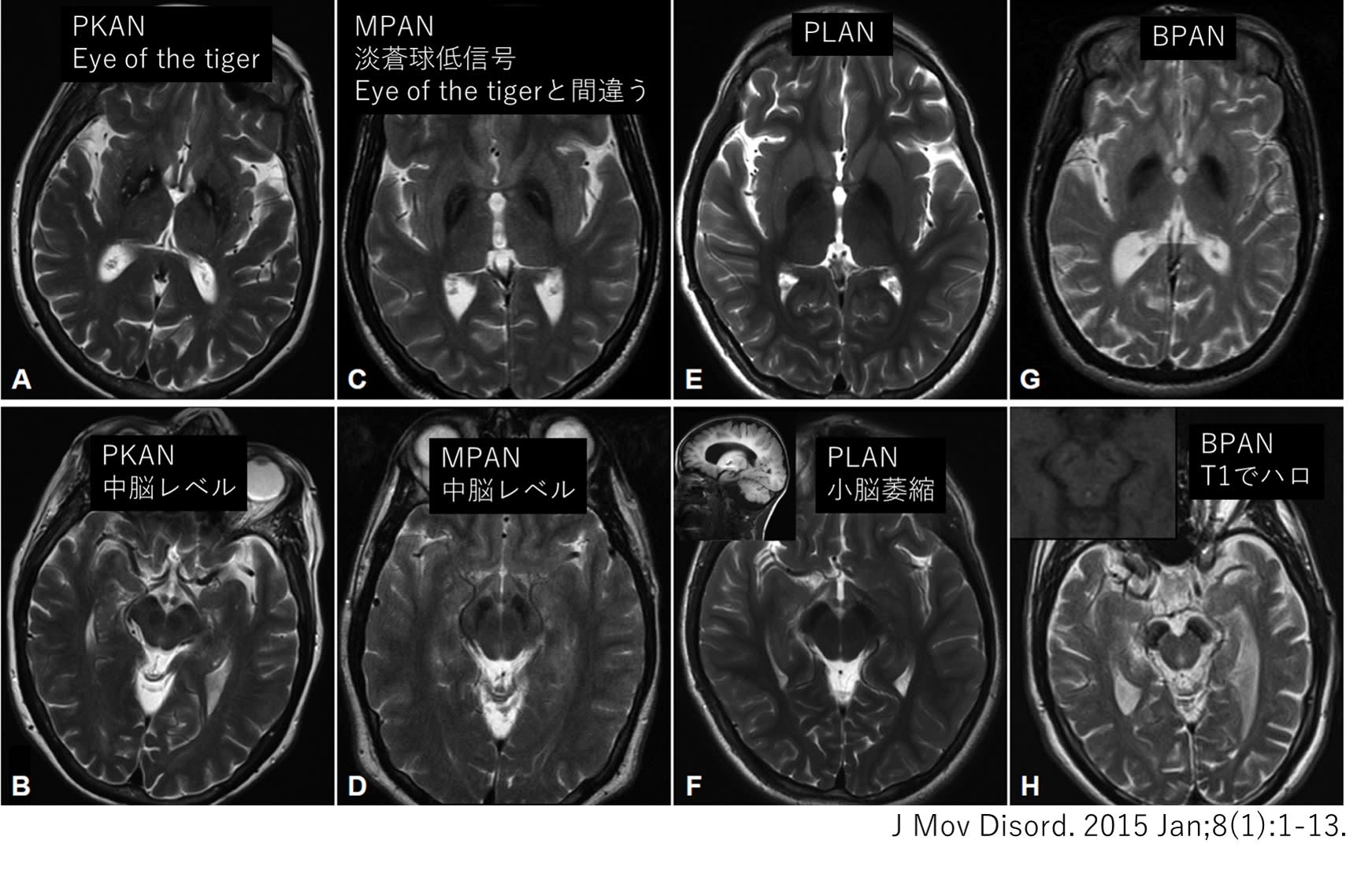
脳内鉄蓄積を伴う神経変性症候群(NBIA: Neurodegeneration with brain iron accumulation)における神経疾患表現型のスペクトラムが拡大している.これらの疾患はMRI(とくにT2WI)の基底核や中脳,小脳の特徴的な所見から気が付かれることが多い(図).多くはPKAN(パントテン酸キナーゼ関連神経変性症)やmembrane protein-associated neurodegeneration(MPAN)のように小児期発症の常染色体劣性遺伝であるが,BPAN(Beta-propeller Protein-Associated Neurodegeneration)のようなX染色体劣性の疾患や,神経フェリチノパチーのような常染色体優性の疾患もある.PLA2G6 associated neurodegeneration(PLAN)の原因遺伝子であるPLA2G6遺伝子はさまざまな表現型を示すことが判明し,当初,ジストニア・パーキンソニズムを呈すると報告されたが,Infantile neuroaxonal dystrophy(INAD)やPARK14に加え,小児発症の舞踏運動も呈しうる.
無セルロプラスミン血症は常染色体劣性,セルロプラスミン遺伝子変異で生じるが,フェロキシダーゼ活性を喪失するためフェリチンレベルが上昇する.成人発症で,認知機能障害,精神症状,行動異常,失調,ジストニアに加え舞踏運動を呈しうる.小脳,基底核,膵臓に鉄が沈着し,糖尿病も併発する.鉄キレート剤が有効な可能性あり.
神経フェリチノパチーは上述のとおり,NBIAで唯一,常染色体優性,フェリチン軽鎖遺伝子変異で生じる.舞踏運動,ジストニア,パーキンソニズムを呈しうる.血清フェリチンは減少する.鉄沈着は基底核,進行すると赤核,歯状核にも見られるようになる.鉄キレート剤の効果は不明である.
以上より,舞踏病では頭部MRIの鉄沈着のチェックに加え,セルロプラスミンとフェリチンの測定は確認すべきである.
【舞踏運動を引き起こす自己抗体】
シデナム舞踏病における抗大脳基底核抗体のような舞踏運動に関連した自己抗体が多数報告されている.傍腫瘍性,ないし非傍腫瘍性の2つに分類できる.随伴症状として,小脳性運動失調,脳炎,痙攣,睡眠障害,stiff-person症候群などを認める.奇妙なことに舞踏運動が一側性のこともあるが,機序は不明(脳が元来対称性でないことが関与しているという説がある?).対処としては,まずCTやPETを用いて腫瘍の検索を行う.見つかった場合にはその治療を行う.見つからない場合は免疫療法(IVIG,ステロイド,血漿交換)が奏効する可能性がある.
腫瘍を認めない舞踏運動に関連した自己抗体
leucine-rich glioma-inactivated 1 (LGI1), NMDA, IgLON5, contactin-associated
protein 2 (CASPR), GAD65, CRMP-5/CV2
傍腫瘍性舞踏運動に関連した自己抗体
Hu, Yo, LGI1, NMDA, IgLON5,CASPR, GAD65, CRMP-5/CV2, striational muscle
【舞踏運動に対する深部刺激療法】
淡蒼球内節(GPi)に対する深部刺激療法は,ハンチントン病や神経有棘赤血球症での有効性が少数例での検討ながら報告されているが,むしろ症状の進行を認めない非変性疾患は良い適応となる.具体的には,視床出血,脳性麻痺,非ケトン性高浸透圧性昏睡があげられる.しかし進行性でも程度が非常に高度な場合には検討してもよいだろう.

Walker RH. The non–Huntington disease choreas. Five new things. Neurol Clin Pract 10.1212/CPJ.0000000000000236
Margolis RL et al. Huntington's Disease-like 2 (HDL2) in North America and Japan. Ann Neurol. 2004 Nov;56(5):670-4.
Shimohata T et al. Novel locus for benign hereditary chorea with adult onset maps to chromosome 8q21.3 q23.3. Brain. 2007 Sep;130(Pt 9):2302-9.
下畑享良ら.舞踏運動の鑑別診断.脳と神経 61(8), 963-971, 2009
ではFive new thingsをまとめたい.
【ADCY5関連ジスキネジア】
adenylate cyclase 5(ADCY5)遺伝子変異は小児期発症の舞踏運動の原因となる(常染色体優性ないしde novo変異).表現型としては発作性舞踏運動(とくに夜間に増悪),ジストニア,ミオクローヌス,低トーヌスを示す.経時的な進行は目立たない.家族性良性舞踏病の原因のひとつと言える.治療としてベンゾジアゼピンが有効.またADCY5は線条体や心筋に高発現するため,最初のレポートの家系では心筋症や心不全が認められた.YouTubeにて動画を見ることができる.
ADCY5-related dyskinesia
【C9ORF72遺伝子変異】
C9ORF72の6塩基反復配列(GGGGCC)の異常伸長は,常染色体優性遺伝形式を示し,ALSや前頭側頭型認知症以外に,ハンチントン病様症状を示す.これらの種々の表現型が同一家系内でも認められることがあるが,その機序は不明である.健常者は2-20リピート程度,それ以上から200~300リポートがintermediate,それ以上から数千までが発症者になる.発症は小児にも見られるが,多くは成年期以降である.上位運動ニューロン徴候や前頭葉徴候がヒントとなる.病理所見はTDP43-opathyであるが,基底核にとくに病理変化が強いかは不明である.
【脳内鉄蓄積を伴う神経変性症候群】
脳内鉄蓄積を伴う神経変性症候群(NBIA: Neurodegeneration with brain iron accumulation)における神経疾患表現型のスペクトラムが拡大している.これらの疾患はMRI(とくにT2WI)の基底核や中脳,小脳の特徴的な所見から気が付かれることが多い(図).多くはPKAN(パントテン酸キナーゼ関連神経変性症)やmembrane protein-associated neurodegeneration(MPAN)のように小児期発症の常染色体劣性遺伝であるが,BPAN(Beta-propeller Protein-Associated Neurodegeneration)のようなX染色体劣性の疾患や,神経フェリチノパチーのような常染色体優性の疾患もある.PLA2G6 associated neurodegeneration(PLAN)の原因遺伝子であるPLA2G6遺伝子はさまざまな表現型を示すことが判明し,当初,ジストニア・パーキンソニズムを呈すると報告されたが,Infantile neuroaxonal dystrophy(INAD)やPARK14に加え,小児発症の舞踏運動も呈しうる.

無セルロプラスミン血症は常染色体劣性,セルロプラスミン遺伝子変異で生じるが,フェロキシダーゼ活性を喪失するためフェリチンレベルが上昇する.成人発症で,認知機能障害,精神症状,行動異常,失調,ジストニアに加え舞踏運動を呈しうる.小脳,基底核,膵臓に鉄が沈着し,糖尿病も併発する.鉄キレート剤が有効な可能性あり.
神経フェリチノパチーは上述のとおり,NBIAで唯一,常染色体優性,フェリチン軽鎖遺伝子変異で生じる.舞踏運動,ジストニア,パーキンソニズムを呈しうる.血清フェリチンは減少する.鉄沈着は基底核,進行すると赤核,歯状核にも見られるようになる.鉄キレート剤の効果は不明である.
以上より,舞踏病では頭部MRIの鉄沈着のチェックに加え,セルロプラスミンとフェリチンの測定は確認すべきである.
【舞踏運動を引き起こす自己抗体】
シデナム舞踏病における抗大脳基底核抗体のような舞踏運動に関連した自己抗体が多数報告されている.傍腫瘍性,ないし非傍腫瘍性の2つに分類できる.随伴症状として,小脳性運動失調,脳炎,痙攣,睡眠障害,stiff-person症候群などを認める.奇妙なことに舞踏運動が一側性のこともあるが,機序は不明(脳が元来対称性でないことが関与しているという説がある?).対処としては,まずCTやPETを用いて腫瘍の検索を行う.見つかった場合にはその治療を行う.見つからない場合は免疫療法(IVIG,ステロイド,血漿交換)が奏効する可能性がある.
腫瘍を認めない舞踏運動に関連した自己抗体
leucine-rich glioma-inactivated 1 (LGI1), NMDA, IgLON5, contactin-associated
protein 2 (CASPR), GAD65, CRMP-5/CV2
傍腫瘍性舞踏運動に関連した自己抗体
Hu, Yo, LGI1, NMDA, IgLON5,CASPR, GAD65, CRMP-5/CV2, striational muscle
【舞踏運動に対する深部刺激療法】
淡蒼球内節(GPi)に対する深部刺激療法は,ハンチントン病や神経有棘赤血球症での有効性が少数例での検討ながら報告されているが,むしろ症状の進行を認めない非変性疾患は良い適応となる.具体的には,視床出血,脳性麻痺,非ケトン性高浸透圧性昏睡があげられる.しかし進行性でも程度が非常に高度な場合には検討してもよいだろう.

Walker RH. The non–Huntington disease choreas. Five new things. Neurol Clin Pract 10.1212/CPJ.0000000000000236

























