脳梗塞後遺症に対する機能回復を目指したさまざまな細胞療法が検討されてきた.今回,新潟大学(金澤雅人先生,畠山公大先生ら),岐阜大学,医療イノベーション推進センター(TRI)のチームは,低酸素・低糖(oxygen glucose deprivation;OGD)刺激で,脳保護的作用を獲得した末梢血単核球による細胞療法を開発し,Scientific Reports誌に発表した.本研究の意義は大きく3つ挙げることができる.
1.薬剤を使用しない簡単な刺激により,末梢血単核球が組織を修復する能力を獲得することを初めて明らかにしたこと.
2.脳梗塞の発症早期からの治療ができ,がん化のリスクもなく,有効で安全な臨床応用が可能となること.
3.専門の細胞培養施設を必要としないため,一般病院においても治療を普及できる可能性があり,かつ再生医療を格段に低コスト化できること.
以下,本研究について解説したい.
【脳梗塞に対する骨髄由来間葉系幹細胞療法の問題点】
脳梗塞に対して期待される細胞療法の代表が骨髄由来間葉系幹細胞である.本邦では条件付きであるが,脊髄損傷に対して再生医療等製品「ステミラック注」が2018年末に保険収載された.同細胞は,脳梗塞病変において,血管内皮増殖因子(VEGF)などの成長因子を分泌し,血管新生や神経軸索の進展を促すことで機能回復を促進すると考えられている.
問題点としては,脳梗塞再発予防のための抗血小板療法,抗凝固療法下での骨髄液採取に危険が伴うこと,十分な細胞数を得るために専用の細胞調整センターを要すること,一症例当たり数千万円以上の費用がかかることが挙げられる.
【本研究のきっかけとしての低酸素・低糖刺激ミクログリア療法】
私たちは従来のアプローチとは異なる細胞療法の確立を目指し,脳内の炎症性細胞であるミクログリアに注目した(Kanazawa et al. Sci Rep 2017).ミクログリアには,マクロファージと同様,活性化の様式からM1型とM2型が存在すると推測されるが,後者は抗炎症性因子の産生や血管新生等を介して,脳梗塞に対して脳保護的に作用する可能性がある.問題はどのような刺激でM2様ミクログリアへ極性変化をさせるかであるが,種々の刺激を検討した結果, 適切な条件のOGD刺激は,ミクログリアの性質をM2様に変化させ,かつその細胞の静注により動物モデルの脳梗塞後の機能回復を促進できることを確認した. OGD刺激によりVEGFやトランスフォーミング増殖因子(TGF-β)などが分泌され,血管新生や神経軸索の進展が促進し,機能回復を来したのである.しかしミクログリアは生体から採取は容易ではないことから,つぎに末梢血から簡便に取得可能で,ミクログリアに性質が類似した末梢血単核球の検討を開始した.
【末梢血単核球もOGD刺激で,脳保護的な性質を獲得する】
末梢血から単核球を分離し,OGD刺激を行ったところ,転写因子PPARγの発現亢進により,ミクログリアと同様にVEGFやTGF-βの分泌が増加することを確認した.ただし単核球から単球・マクロファージを分離して検討を行ったが,これらの細胞単独よりも,それらを含む単核球成分の方がVEGFやTGF-βの分泌増加は明らかであり,血球同士の何らかの相乗効果があるものと考えた.またOGD刺激をした末梢血単核球では,炎症性マクロファージが発現するiNOSが減少し,抗炎症性マクロファージが発現するCD206が増加することを確認し,脳保護的に変化していた.
【OGD刺激末梢血単核球は,MCP-1分泌を介して脳内に移行する】
脳には外部からの物質,細胞の移行をブロックする強力なバリアー機能,血液脳関門が存在する.私たちはOGD刺激末梢血単核球が,血液脳関門を越えて脳内に移行するかを検討した.自家蛍光を発するGFPマウス由来の末梢血単核球にOGD刺激を行い,脳梗塞後1週間経過したラットの頸動脈から投与し,3日後に観察したところ,脳梗塞病変周囲に細胞を認め,脳内移行が確認された.一方,OGD刺激を行わない末梢血単核球は脳内に移行しなかった.OGD刺激により末梢血単核球が脳内移行性を獲得するメカニズムとして,単球の遊走促進因子として発見され,幹細胞においても血液脳関門の透過に関与するMCP-1の分泌亢進が生じていることを確認した.
【OGD刺激末梢血単核球は,脳内での組織修復因子の増加をもたらす】
免疫染色を用いた検証で,脳内に移行したOGD刺激末梢血単核球は,実際に脳梗塞周囲でのVEGF,TGF-βの発現を亢進させることを確認した.
【OGD刺激はin vitro/in vivoで,SSEA-3陽性細胞(MUSE細胞)増加をもたらす】
多能性幹細胞マーカーであるstage-specific embryonic antigen-3(SSEA-3)陽性細胞(いわゆるMuse細胞:Multi-lineage differentiating Stress Enduring cell)を用いた細胞療法が,脳梗塞モデルに対し有効であることが報告されている.そこでOGD刺激を行った末梢血単核球中のSSEA-3陽性細胞の数をFACSで測定したところ,通常培養を行った場合と比較して増加していることを確認した.またOGD刺激末梢血単核球を脳梗塞ラットに動注すると,対照群と比較して,脳中のSSEA-3陽性細胞が増加することも確認した.これは非常に驚くべき結果であった.
【OGD刺激末梢血単核球は,血管新生を介して,神経再生をもたらす】
近年,神経再生の前段階で血管新生が必要であることを示唆する研究が報告されている.脳梗塞ラットに,OGD刺激末梢血単核球を動注すると,OGD刺激を行わない細胞の場合と比較して,脳梗塞巣の辺縁で血管新生が促進され(下図上段),さらに神経軸索の進展も促進されていることを確認した(下図下段).

【OGD刺激末梢血単核球は,脳梗塞後遺症を改善する】
実際に脳梗塞ラットの後遺症が改善するか,コーナーテストという方法で評価した.無治療の場合,脳梗塞28日後でも症状はほとんど改善せず,またOGD刺激を行わない末梢血単核球を,脳梗塞後7日目に投与した場合も症状は改善しない.しかし,OGD刺激末梢血単核球は動注すると,症状は有意に改善した(下図).

【まとめ】
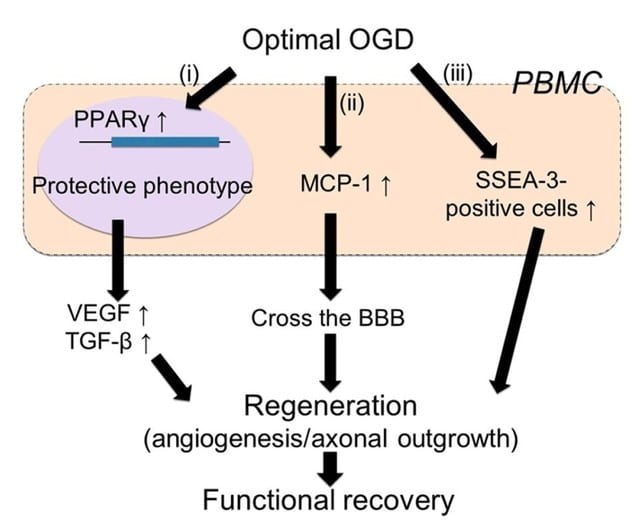
OGD刺激末梢血単核球の作用機序としては,図に示す3つが考えられた.
1)組織修復因子(VEGF, TGF-β)の分泌
2)MCP-1を介した血液脳関門通過能の獲得
3)多能性幹細胞SSEA-3陽性細胞(Muse細胞)数の増加
これらの作用を介してOGD刺激末梢血単核球は脳内移行し,血管新生,神経軸索進展を促進し,脳梗塞後遺症を改善させる.
本技術は,簡単な操作で細胞療法が可能となるため,実用化されれば,一般病院にも普及できる可能性がある.現在,採血から細胞の分離,OGD刺激までを一貫して行える装置を,産学官共同で開発中であり,早期の臨床応用を目指している.
Hatakeyama M, Kanazawa M, Ninomiya I, Omae K, Kimura Y, Takahashi T, Onodera O, Fukushima M, Shimohata T. A novel therapeutic approach using peripheral blood mononuclear cells preconditioned by oxygen-glucose deprivation. Sci Rep. 2019 Nov 14;9(1):16819. doi: 10.1038/s41598-019-53418-5.
1.薬剤を使用しない簡単な刺激により,末梢血単核球が組織を修復する能力を獲得することを初めて明らかにしたこと.
2.脳梗塞の発症早期からの治療ができ,がん化のリスクもなく,有効で安全な臨床応用が可能となること.
3.専門の細胞培養施設を必要としないため,一般病院においても治療を普及できる可能性があり,かつ再生医療を格段に低コスト化できること.
以下,本研究について解説したい.
【脳梗塞に対する骨髄由来間葉系幹細胞療法の問題点】
脳梗塞に対して期待される細胞療法の代表が骨髄由来間葉系幹細胞である.本邦では条件付きであるが,脊髄損傷に対して再生医療等製品「ステミラック注」が2018年末に保険収載された.同細胞は,脳梗塞病変において,血管内皮増殖因子(VEGF)などの成長因子を分泌し,血管新生や神経軸索の進展を促すことで機能回復を促進すると考えられている.
問題点としては,脳梗塞再発予防のための抗血小板療法,抗凝固療法下での骨髄液採取に危険が伴うこと,十分な細胞数を得るために専用の細胞調整センターを要すること,一症例当たり数千万円以上の費用がかかることが挙げられる.
【本研究のきっかけとしての低酸素・低糖刺激ミクログリア療法】
私たちは従来のアプローチとは異なる細胞療法の確立を目指し,脳内の炎症性細胞であるミクログリアに注目した(Kanazawa et al. Sci Rep 2017).ミクログリアには,マクロファージと同様,活性化の様式からM1型とM2型が存在すると推測されるが,後者は抗炎症性因子の産生や血管新生等を介して,脳梗塞に対して脳保護的に作用する可能性がある.問題はどのような刺激でM2様ミクログリアへ極性変化をさせるかであるが,種々の刺激を検討した結果, 適切な条件のOGD刺激は,ミクログリアの性質をM2様に変化させ,かつその細胞の静注により動物モデルの脳梗塞後の機能回復を促進できることを確認した. OGD刺激によりVEGFやトランスフォーミング増殖因子(TGF-β)などが分泌され,血管新生や神経軸索の進展が促進し,機能回復を来したのである.しかしミクログリアは生体から採取は容易ではないことから,つぎに末梢血から簡便に取得可能で,ミクログリアに性質が類似した末梢血単核球の検討を開始した.
【末梢血単核球もOGD刺激で,脳保護的な性質を獲得する】
末梢血から単核球を分離し,OGD刺激を行ったところ,転写因子PPARγの発現亢進により,ミクログリアと同様にVEGFやTGF-βの分泌が増加することを確認した.ただし単核球から単球・マクロファージを分離して検討を行ったが,これらの細胞単独よりも,それらを含む単核球成分の方がVEGFやTGF-βの分泌増加は明らかであり,血球同士の何らかの相乗効果があるものと考えた.またOGD刺激をした末梢血単核球では,炎症性マクロファージが発現するiNOSが減少し,抗炎症性マクロファージが発現するCD206が増加することを確認し,脳保護的に変化していた.
【OGD刺激末梢血単核球は,MCP-1分泌を介して脳内に移行する】
脳には外部からの物質,細胞の移行をブロックする強力なバリアー機能,血液脳関門が存在する.私たちはOGD刺激末梢血単核球が,血液脳関門を越えて脳内に移行するかを検討した.自家蛍光を発するGFPマウス由来の末梢血単核球にOGD刺激を行い,脳梗塞後1週間経過したラットの頸動脈から投与し,3日後に観察したところ,脳梗塞病変周囲に細胞を認め,脳内移行が確認された.一方,OGD刺激を行わない末梢血単核球は脳内に移行しなかった.OGD刺激により末梢血単核球が脳内移行性を獲得するメカニズムとして,単球の遊走促進因子として発見され,幹細胞においても血液脳関門の透過に関与するMCP-1の分泌亢進が生じていることを確認した.
【OGD刺激末梢血単核球は,脳内での組織修復因子の増加をもたらす】
免疫染色を用いた検証で,脳内に移行したOGD刺激末梢血単核球は,実際に脳梗塞周囲でのVEGF,TGF-βの発現を亢進させることを確認した.
【OGD刺激はin vitro/in vivoで,SSEA-3陽性細胞(MUSE細胞)増加をもたらす】
多能性幹細胞マーカーであるstage-specific embryonic antigen-3(SSEA-3)陽性細胞(いわゆるMuse細胞:Multi-lineage differentiating Stress Enduring cell)を用いた細胞療法が,脳梗塞モデルに対し有効であることが報告されている.そこでOGD刺激を行った末梢血単核球中のSSEA-3陽性細胞の数をFACSで測定したところ,通常培養を行った場合と比較して増加していることを確認した.またOGD刺激末梢血単核球を脳梗塞ラットに動注すると,対照群と比較して,脳中のSSEA-3陽性細胞が増加することも確認した.これは非常に驚くべき結果であった.
【OGD刺激末梢血単核球は,血管新生を介して,神経再生をもたらす】
近年,神経再生の前段階で血管新生が必要であることを示唆する研究が報告されている.脳梗塞ラットに,OGD刺激末梢血単核球を動注すると,OGD刺激を行わない細胞の場合と比較して,脳梗塞巣の辺縁で血管新生が促進され(下図上段),さらに神経軸索の進展も促進されていることを確認した(下図下段).

【OGD刺激末梢血単核球は,脳梗塞後遺症を改善する】
実際に脳梗塞ラットの後遺症が改善するか,コーナーテストという方法で評価した.無治療の場合,脳梗塞28日後でも症状はほとんど改善せず,またOGD刺激を行わない末梢血単核球を,脳梗塞後7日目に投与した場合も症状は改善しない.しかし,OGD刺激末梢血単核球は動注すると,症状は有意に改善した(下図).

【まとめ】
OGD刺激末梢血単核球の作用機序としては,図に示す3つが考えられた.
1)組織修復因子(VEGF, TGF-β)の分泌
2)MCP-1を介した血液脳関門通過能の獲得
3)多能性幹細胞SSEA-3陽性細胞(Muse細胞)数の増加
これらの作用を介してOGD刺激末梢血単核球は脳内移行し,血管新生,神経軸索進展を促進し,脳梗塞後遺症を改善させる.

本技術は,簡単な操作で細胞療法が可能となるため,実用化されれば,一般病院にも普及できる可能性がある.現在,採血から細胞の分離,OGD刺激までを一貫して行える装置を,産学官共同で開発中であり,早期の臨床応用を目指している.
Hatakeyama M, Kanazawa M, Ninomiya I, Omae K, Kimura Y, Takahashi T, Onodera O, Fukushima M, Shimohata T. A novel therapeutic approach using peripheral blood mononuclear cells preconditioned by oxygen-glucose deprivation. Sci Rep. 2019 Nov 14;9(1):16819. doi: 10.1038/s41598-019-53418-5.

























