今回のキーワードは,COVID-19軽症感染でも脳血管周囲に明らかな病理変化が生じている!最多の神経合併症は認知機能障害であった,パクスロビド®はlong COVIDのリスクを低減する,長期の嗅覚障害の機序は支持細胞の長期の炎症による,オミクロン変異株は中和抗体に加え,T細胞も回避して感染拡大を引き起こす,小児では持続的適応免疫が扁桃/アデノイドで生じ,long COVIDに関与する可能性がある,小児の多系統炎症症候群の原因遺伝子が複数同定された,です.
1番の衝撃は数日間の発熱,咳嗽を呈しただけの患者であっても脳の微小血管障害が生じるというNeurology誌の症例報告です.前回ご紹介したNature論文で,呼吸器系にとどまらず,多くの臓器に感染が早期から広がり,脳にも到達し,独自に増殖しうることが示されていますが矛盾しない報告です.炎症が生じやすいのは臓器では呼吸器,年齢では成人であって,それ以外の臓器や小児では炎症を伴いにくいため症状が出にくいと推測されます.症状がなくてもウイルスは持続感染,潜伏感染しうるわけで,すでに米国ではリザーバー(潜伏臓器)探しが進められています.今回の報告の中では小児における扁桃およびアデノイドにおける持続感染が注目されます.またlong COVIDに対し抗ウイルス薬パクスロビド®が有効であることが示されましたので,持続感染が長期的な症状をもたらす可能性はさらに高まったと言えます.免疫回避現象の機序など驚愕しますが,どんどん巧妙に進化し感染を広げるウイルスに,人間はきちんと対抗できているでしょうか?改めて感染防御とワクチンブースター接種を励行し,自身と高齢者を守る必要があります.
◆COVID-19軽症感染でも脳血管周囲に明らかな病理変化が生じている!
11年におよぶ難治性てんかんを有する27歳米国人女性が,外科治療目的に入院.入院中に感染したが,数日間の発熱,咳嗽を呈した後に治癒.脳炎を含む神経合併症なし.発症から17日後に焦点である左前側頭葉の切除を施行した.血管周囲に細胞接着因子PECAM-1発現の増加を認め血管内皮細胞の活性化が示唆され,さらに対照と比較して,血管周囲のフィブリノゲン漏出およびマクロファージ,CD8リンパ球を含む免疫細胞の浸潤,グリア細胞活性化を認めた(図1).ウイルス抗原は免疫染色では検出できなかったが,超遠心法により脳生検組織から細胞外小胞を分離したところ,ウイルスヌクレオカプシド蛋白の存在を確認した.N蛋白やウイルスRNAを認めなかったことより,末梢由来と考えられた.以上より,軽症の感染でも多くの患者に微小血管障害が一過性に生じている可能性がある.著者はこのような所見の長期持続がlong COVIDを来している可能性もあると議論している.
Neurology. 2022 Dec 16:10.1212/WNL.0000000000201682.(doi.org/10.1212/WNL.0000000000201682)

◆最多の神経合併症は認知症であった
欧州23カ国とその他7カ国の国際研究において,急性期~亜急性期の神経学的合併症を評価した研究が報告された.2021年7月までに,神経合併症を呈した1213人が検討された.主なものは,認知症(29.5%)が最も多く,ついで脳卒中(25.7%),睡眠覚醒障害(16.4%),自律神経障害(14.7%),末梢神経障害(9.5%),運動異常症(N=142,9.3%),運動失調(8.8%),けいれん発作(8.3%)であった.認知機能障害を合併した患者は非合併患者より10歳高齢で,脳卒中やパーキンソン病を基礎疾患に持つ人,重篤な感染の人が多く,生命・機能予後が不良で,入院中死亡も多かった.→ 既報では認知症は急性期~亜急性期の神経合併症として認識されていなかったが,追加すると最多であった.
Eur J Neurol. Oct 31, 2022(doi.org/10.1111/ene.15617)
◆パクスロビド®はlong COVIDのリスクを低減する
米国からの注目される未査読論文.急性期における抗ウイルス薬ニルマトルビル(パクスロビド®)が後遺症のリスクを低減させるか検証することを目的とした.米国退役軍人省のデータベースを用いて,2022年3月から6月の間にPCR陽性の当日に入院しておらず,重症化のリスク因子が少なくとも1つあり,診断後30日間生存した患者を特定した.陽性反応後5日以内にニルマトルビルの経口投与を受けた9217人と,対照群4万7123人を同定し,90日後の評価を行った(注:こういう研究が日本ではできない).対照群と比較して,ニルマトルビルによる治療は後遺症をきたす確率が26%少なかった(ハザード比0.74, 絶対リスク減少率ARR 2.32)(図2).また心血管系,凝固・血液系障害,疲労,肝疾患,急性腎疾患,筋痛,認知障害,息切れにおける12の後遺症のうち10のリスクを減少させた.急性期以降の死亡を48%(HR 0.52, ARR 0.28),急性期以降の入院を30%(HR 0.70, ARR)減少した.ワクチン接種の有無,ブースター接種,初感染,再感染にかかわらず後遺症リスクを低減した.糖尿病発症リスクは減少しなかった.以上より重症化の危険因子を少なくとも1つ持つ感染者において,検査陽性5日以内のニルマトルビル治療は,ワクチン接種状況や過去の感染歴にかかわらず後遺症のリスクを低減できる.
medRxiv November 05, 2022. (doi.org/10.1101/2022.11.03.22281783)

◆長期の嗅覚障害の機序は支持細胞の長期の炎症による
米国から長期(数ヶ月から数年)の嗅覚障害の機序について検討した研究が報告された.長期の嗅覚消失を示す9人の患者を含む24の生検嗅上皮サンプルを解析した.IFN-γを発現するT細胞のびまん性浸潤と,CD207+樹状細胞(ランゲルハンス細胞)の濃縮,そして抗炎症に作用するM2マクロファージの枯渇を含む骨髄系細胞集団のシフトが認められた.SARS-CoV-2 ウイルスRNAやタンパク質が検出されなかったが,嗅上皮の支持細胞における遺伝子発現は進行中の炎症に対する反応を示唆し,嗅覚神経細胞の数の減少に関わるものと考えられた.以上より,SARS-CoV-2ウイルスが嗅上皮から排除された後も,T細胞を介した炎症が長期間持続することが長期の嗅覚障害のメカニズムと考えられた.→ ヒト剖検にて,嗅覚障害重症例で嗅神経の軸索減少が報告されているが,近傍の支持細胞の持続炎症が原因ということになる.
Sci Transl Med. 2022 Dec 21;14(676):eadd0484.(doi.org/10.1126/scitranslmed.add0484)
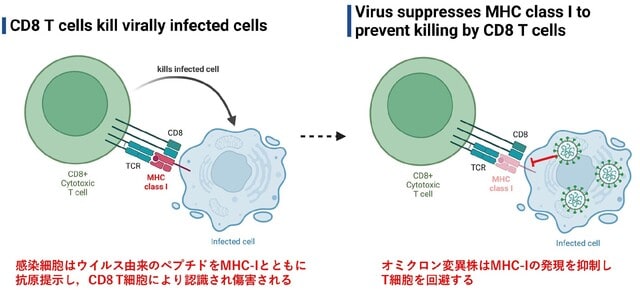
◆オミクロン変異株は中和抗体に加え,T細胞も回避して感染拡大を引き起こす
オミクロン変異株(VOC)によるブレイクスルー感染や再感染の機序として,免疫逃避能の獲得がしばしば議論されている.その機序として,スパイクタンパク質への中和抗体に対する抵抗性を有することが知られているが,VOCがCD8+T細胞を介した免疫を回避するかは不明である.プレプリント論文で,イェール大学から,VOCが主要組織適合性複合体クラスI(MHC-I)の発現を抑制する能力を有していることが明らかにされた(図3).ちなみにすべての有核細胞は,図3左のようにMHC-Iを持つ.細胞は感染したウイルスタンパクをペプチドに分解し,MHC Iとともに抗原提示するが,VOCはMHC-Iを抑制してしまうのでT細胞からの攻撃を免れてしまう.また著者らはMHC-Iの発現抑制に関わるウイルス遺伝子を複数同定した.オリジナル株や初期の変異株もMHC-I発現抑制能力を有していたが,オミクロン変異株はより強力であった.
bioRxiv. Dec 23, 2022.(doi.org/10.1101/2022.05.04.490614)
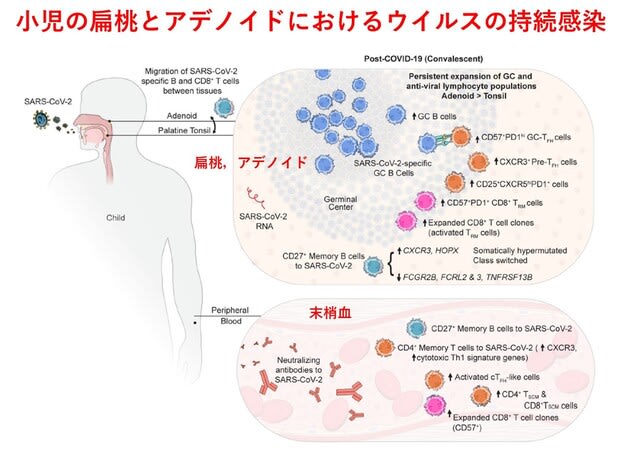
◆小児では持続的適応免疫が扁桃/アデノイドで生じ,long COVIDに関与する可能性がある
SARS-CoV-2ウイルス感染に対する適応(獲得)免疫に関する研究の多くは末梢血に着目しており,感染部位の免疫反応を評価できていない.米国からの研究で,パンデミック後に扁桃摘出術およびアデノイド切除術を受けた小児110人の検体を収集し,血清中の中和抗体,扁桃およびアデノイドのSARS-CoV-2特異的胚中心細胞およびメモリーB細胞を検討し,既感染が示唆された24検体を同定した.単一細胞におけるB細胞受容体(BCR)配列決定を行ったところ,ウイルス特異的BCRにクラススイッチされ,体細胞的に超変異(抗体の多様性をつくり出すために免疫グロブリン遺伝子の可変領域に高頻度の変異が導入される現象)しており,扁桃腺,アデノイドでクローンが重複していた.感染後の扁桃腺,アデノイドおよび血液中にT細胞クローン型の拡大が認められ,一部はこれまでに報告されたSARS-CoV-2反応性T細胞受容体(TCR)と同一のCDR3配列(抗原特異性を決定する重要な部分)を有していた.COVID-19発症小児のアデノイドでIFN-γ型反応に関連した胚中心および抗ウイルスリンパ球集団の持続的な拡大が見られ,両組織でウイルスRNAが検出された.以上より,小児の上気道におけるSARS-CoV-2ウイルスに対する組織特異的な免疫が,感染後も持続的に存在することが示された(図4).著者らはこれらの現象が小児のlong COVIDや多系統炎症症候群(MIS-C)に関与する可能性を議論している.
Nat Immunol. Dec 19, 2022. (doi.org/10.1038/s41590-022-01367-z)
◆小児の多系統炎症症候群の原因遺伝子が複数同定された
小児の多系統炎症症候群(MIS-C)は,感染の2~6週間後に複数の臓器不全を来たし,重篤な状況を招くが,その原因は不明であった.フランスを中心とする国際研究で,MIS-Cを発症した5人の血縁関係のない小児においてOAS1,OAS2,RNASEL遺伝子の常染色体潜性変異を同定した(図5).このOAS1とOAS2は細胞質で二本鎖RNAを感知し,二本鎖RNAを分解するRNase Lを活性化する2-5′-結合オリゴアデニル酸(2-5A)を生成する分子である.これらのいずれかを欠損した単核球細胞や骨髄細胞は二本鎖RNAやSARS-CoV-2ウイルスの刺激で,炎症性サイトカインを過剰に産生した.OASやRNase Lの欠損はSARS-CoV-2感染を契機とするMAVS(感染RNAウイルスを検知するミトコンドリアのシステム)を介した高度の炎症性サイトカイン生成をもたらし,MIS-Cを引き起こすと考えられる.
Science. 2022 Dec 20:eabo3627.(doi.org/10.1126/science.abo3627)

1番の衝撃は数日間の発熱,咳嗽を呈しただけの患者であっても脳の微小血管障害が生じるというNeurology誌の症例報告です.前回ご紹介したNature論文で,呼吸器系にとどまらず,多くの臓器に感染が早期から広がり,脳にも到達し,独自に増殖しうることが示されていますが矛盾しない報告です.炎症が生じやすいのは臓器では呼吸器,年齢では成人であって,それ以外の臓器や小児では炎症を伴いにくいため症状が出にくいと推測されます.症状がなくてもウイルスは持続感染,潜伏感染しうるわけで,すでに米国ではリザーバー(潜伏臓器)探しが進められています.今回の報告の中では小児における扁桃およびアデノイドにおける持続感染が注目されます.またlong COVIDに対し抗ウイルス薬パクスロビド®が有効であることが示されましたので,持続感染が長期的な症状をもたらす可能性はさらに高まったと言えます.免疫回避現象の機序など驚愕しますが,どんどん巧妙に進化し感染を広げるウイルスに,人間はきちんと対抗できているでしょうか?改めて感染防御とワクチンブースター接種を励行し,自身と高齢者を守る必要があります.
◆COVID-19軽症感染でも脳血管周囲に明らかな病理変化が生じている!
11年におよぶ難治性てんかんを有する27歳米国人女性が,外科治療目的に入院.入院中に感染したが,数日間の発熱,咳嗽を呈した後に治癒.脳炎を含む神経合併症なし.発症から17日後に焦点である左前側頭葉の切除を施行した.血管周囲に細胞接着因子PECAM-1発現の増加を認め血管内皮細胞の活性化が示唆され,さらに対照と比較して,血管周囲のフィブリノゲン漏出およびマクロファージ,CD8リンパ球を含む免疫細胞の浸潤,グリア細胞活性化を認めた(図1).ウイルス抗原は免疫染色では検出できなかったが,超遠心法により脳生検組織から細胞外小胞を分離したところ,ウイルスヌクレオカプシド蛋白の存在を確認した.N蛋白やウイルスRNAを認めなかったことより,末梢由来と考えられた.以上より,軽症の感染でも多くの患者に微小血管障害が一過性に生じている可能性がある.著者はこのような所見の長期持続がlong COVIDを来している可能性もあると議論している.
Neurology. 2022 Dec 16:10.1212/WNL.0000000000201682.(doi.org/10.1212/WNL.0000000000201682)

◆最多の神経合併症は認知症であった
欧州23カ国とその他7カ国の国際研究において,急性期~亜急性期の神経学的合併症を評価した研究が報告された.2021年7月までに,神経合併症を呈した1213人が検討された.主なものは,認知症(29.5%)が最も多く,ついで脳卒中(25.7%),睡眠覚醒障害(16.4%),自律神経障害(14.7%),末梢神経障害(9.5%),運動異常症(N=142,9.3%),運動失調(8.8%),けいれん発作(8.3%)であった.認知機能障害を合併した患者は非合併患者より10歳高齢で,脳卒中やパーキンソン病を基礎疾患に持つ人,重篤な感染の人が多く,生命・機能予後が不良で,入院中死亡も多かった.→ 既報では認知症は急性期~亜急性期の神経合併症として認識されていなかったが,追加すると最多であった.
Eur J Neurol. Oct 31, 2022(doi.org/10.1111/ene.15617)
◆パクスロビド®はlong COVIDのリスクを低減する
米国からの注目される未査読論文.急性期における抗ウイルス薬ニルマトルビル(パクスロビド®)が後遺症のリスクを低減させるか検証することを目的とした.米国退役軍人省のデータベースを用いて,2022年3月から6月の間にPCR陽性の当日に入院しておらず,重症化のリスク因子が少なくとも1つあり,診断後30日間生存した患者を特定した.陽性反応後5日以内にニルマトルビルの経口投与を受けた9217人と,対照群4万7123人を同定し,90日後の評価を行った(注:こういう研究が日本ではできない).対照群と比較して,ニルマトルビルによる治療は後遺症をきたす確率が26%少なかった(ハザード比0.74, 絶対リスク減少率ARR 2.32)(図2).また心血管系,凝固・血液系障害,疲労,肝疾患,急性腎疾患,筋痛,認知障害,息切れにおける12の後遺症のうち10のリスクを減少させた.急性期以降の死亡を48%(HR 0.52, ARR 0.28),急性期以降の入院を30%(HR 0.70, ARR)減少した.ワクチン接種の有無,ブースター接種,初感染,再感染にかかわらず後遺症リスクを低減した.糖尿病発症リスクは減少しなかった.以上より重症化の危険因子を少なくとも1つ持つ感染者において,検査陽性5日以内のニルマトルビル治療は,ワクチン接種状況や過去の感染歴にかかわらず後遺症のリスクを低減できる.
medRxiv November 05, 2022. (doi.org/10.1101/2022.11.03.22281783)

◆長期の嗅覚障害の機序は支持細胞の長期の炎症による
米国から長期(数ヶ月から数年)の嗅覚障害の機序について検討した研究が報告された.長期の嗅覚消失を示す9人の患者を含む24の生検嗅上皮サンプルを解析した.IFN-γを発現するT細胞のびまん性浸潤と,CD207+樹状細胞(ランゲルハンス細胞)の濃縮,そして抗炎症に作用するM2マクロファージの枯渇を含む骨髄系細胞集団のシフトが認められた.SARS-CoV-2 ウイルスRNAやタンパク質が検出されなかったが,嗅上皮の支持細胞における遺伝子発現は進行中の炎症に対する反応を示唆し,嗅覚神経細胞の数の減少に関わるものと考えられた.以上より,SARS-CoV-2ウイルスが嗅上皮から排除された後も,T細胞を介した炎症が長期間持続することが長期の嗅覚障害のメカニズムと考えられた.→ ヒト剖検にて,嗅覚障害重症例で嗅神経の軸索減少が報告されているが,近傍の支持細胞の持続炎症が原因ということになる.
Sci Transl Med. 2022 Dec 21;14(676):eadd0484.(doi.org/10.1126/scitranslmed.add0484)
◆オミクロン変異株は中和抗体に加え,T細胞も回避して感染拡大を引き起こす
オミクロン変異株(VOC)によるブレイクスルー感染や再感染の機序として,免疫逃避能の獲得がしばしば議論されている.その機序として,スパイクタンパク質への中和抗体に対する抵抗性を有することが知られているが,VOCがCD8+T細胞を介した免疫を回避するかは不明である.プレプリント論文で,イェール大学から,VOCが主要組織適合性複合体クラスI(MHC-I)の発現を抑制する能力を有していることが明らかにされた(図3).ちなみにすべての有核細胞は,図3左のようにMHC-Iを持つ.細胞は感染したウイルスタンパクをペプチドに分解し,MHC Iとともに抗原提示するが,VOCはMHC-Iを抑制してしまうのでT細胞からの攻撃を免れてしまう.また著者らはMHC-Iの発現抑制に関わるウイルス遺伝子を複数同定した.オリジナル株や初期の変異株もMHC-I発現抑制能力を有していたが,オミクロン変異株はより強力であった.
bioRxiv. Dec 23, 2022.(doi.org/10.1101/2022.05.04.490614)

◆小児では持続的適応免疫が扁桃/アデノイドで生じ,long COVIDに関与する可能性がある
SARS-CoV-2ウイルス感染に対する適応(獲得)免疫に関する研究の多くは末梢血に着目しており,感染部位の免疫反応を評価できていない.米国からの研究で,パンデミック後に扁桃摘出術およびアデノイド切除術を受けた小児110人の検体を収集し,血清中の中和抗体,扁桃およびアデノイドのSARS-CoV-2特異的胚中心細胞およびメモリーB細胞を検討し,既感染が示唆された24検体を同定した.単一細胞におけるB細胞受容体(BCR)配列決定を行ったところ,ウイルス特異的BCRにクラススイッチされ,体細胞的に超変異(抗体の多様性をつくり出すために免疫グロブリン遺伝子の可変領域に高頻度の変異が導入される現象)しており,扁桃腺,アデノイドでクローンが重複していた.感染後の扁桃腺,アデノイドおよび血液中にT細胞クローン型の拡大が認められ,一部はこれまでに報告されたSARS-CoV-2反応性T細胞受容体(TCR)と同一のCDR3配列(抗原特異性を決定する重要な部分)を有していた.COVID-19発症小児のアデノイドでIFN-γ型反応に関連した胚中心および抗ウイルスリンパ球集団の持続的な拡大が見られ,両組織でウイルスRNAが検出された.以上より,小児の上気道におけるSARS-CoV-2ウイルスに対する組織特異的な免疫が,感染後も持続的に存在することが示された(図4).著者らはこれらの現象が小児のlong COVIDや多系統炎症症候群(MIS-C)に関与する可能性を議論している.
Nat Immunol. Dec 19, 2022. (doi.org/10.1038/s41590-022-01367-z)

◆小児の多系統炎症症候群の原因遺伝子が複数同定された
小児の多系統炎症症候群(MIS-C)は,感染の2~6週間後に複数の臓器不全を来たし,重篤な状況を招くが,その原因は不明であった.フランスを中心とする国際研究で,MIS-Cを発症した5人の血縁関係のない小児においてOAS1,OAS2,RNASEL遺伝子の常染色体潜性変異を同定した(図5).このOAS1とOAS2は細胞質で二本鎖RNAを感知し,二本鎖RNAを分解するRNase Lを活性化する2-5′-結合オリゴアデニル酸(2-5A)を生成する分子である.これらのいずれかを欠損した単核球細胞や骨髄細胞は二本鎖RNAやSARS-CoV-2ウイルスの刺激で,炎症性サイトカインを過剰に産生した.OASやRNase Lの欠損はSARS-CoV-2感染を契機とするMAVS(感染RNAウイルスを検知するミトコンドリアのシステム)を介した高度の炎症性サイトカイン生成をもたらし,MIS-Cを引き起こすと考えられる.
Science. 2022 Dec 20:eabo3627.(doi.org/10.1126/science.abo3627)


























