血液脳関門(BBB)は,血液と脳の間に存在するバリアであり,外部からの有害物質が脳に入ることを防ぐとともに,神経細胞の正常な機能維持に重要な役割を果たします.BBBの働きは,脳内血管の内皮細胞,周皮細胞,アストロサイトなどの相互作用によって維持されていますが,そのなかでも「グリコカリックス」という糖鎖に富んだ層が重要であることが最近の研究で注目されています(図1).このグリコカリックスの異常が加齢や神経変性疾患におけるBBBの機能障害に関与していることを明らかにした論文が,スタンフォード大学を中心とするグループからNature誌に掲載されています.
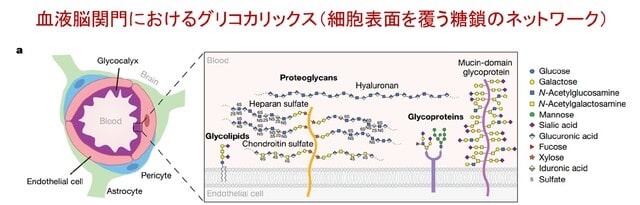
まずマウスを用いて加齢や神経変性疾患がグリコカリックスにどのような影響を与えるかを検討しています.電子顕微鏡を用いた観察により,若齢マウス(3カ月齢)では脳血管の内皮細胞に厚いグリコカリックス層(0.540 ± 0.086 µm)が存在するのに対し,老齢マウス(21カ月齢)ではこの層が顕著に薄くなり(0.232 ± 0.092 µm),グリコカリックスの占める面積比も低下(0.367 ± 0.054 → 0.207 ± 0.047)していることが明らかになりました(図2).

さらに,グリコカリックスにおいて重要な「ムチン型O-グリコシル化(mucin-type O-glycosylation)*」が特に低下していることが,RNAシーケンス解析によって確認されました.例えば,この減少に係るC1GALT1遺伝子の発現は加齢によって50%以上低下し,B3GNT3遺伝子も有意に減少していました.この変化は,アルツハイマー病やハンチントン病の患者脳においても共通して見られ,神経疾患におけるBBB機能不全の原因の一つである可能性が示唆されました.
*SerまたはThr残基にO-結合型で糖鎖が付加されるグリコシル化の一種で,特にムチンと呼ばれる高分子糖タンパク質に特徴的な修飾のこと.
つぎにムチン型O-グリコシル化を特異的に分解する酵素「StcE」を用いた実験を行っています.若齢マウスにこの酵素を投与すると,グリコカリックスが急激に破壊され,BBBの透過性が著しく増加することが分かりました.さらにC1GALT1のノックダウンを行っても,BBBの透過性が亢進し,血液成分が脳内に漏れ出し,最終的には脳出血まで引き起こされました(図3).特に,StcEを48時間持続的に投与したマウスでは,BBBのバリア機能が完全に破綻し,脳出血が発生しました.その影響は顕著で,脳内の血管透過性を示すSulfo-NHS-biotinトレーサーの漏出量が約3倍に増加しました.

次に,この異常を修復することでBBBの機能が回復するかどうかを検証するため,C1GALT1とB3GNT3をアデノ随伴ウイルス(AAV)を用いてマウス脳血管に導入しました.この結果,ムチン型O-グリコシル化が回復し,BBBの透過性が改善し,血液成分の漏れが顕著に減少しました.具体的にはトレーサーの漏出量が 50%以上抑制されました.さらに,この処置によって神経炎症が抑制され,認知機能が向上することも確認されました.特にB3GNT3の過剰発現は,老化に伴う神経細胞の遺伝子発現変化を若齢状態に近づける効果を示し,Y迷路テストでは 20%以上のスコア向上,恐怖条件付けテストでは 40%以上の記憶改善が見られました.
本研究のポイントは,BBB機能不全における新たな治療標的としてグリコカリックス,特にムチン型O-グリコシル化が重要であることを示した点です.これまでBBBの機能破綻は,BBBを構成する細胞やタイトジャンクションの異常が主な原因として考えられてきましたが,本研究はグリコカリックスがその根本的な要因の一つであることを示したものです(図4).

さらに,AAVを用いた遺伝子治療がBBBの機能回復に有効であることを示唆しており,アルツハイマー病などの神経変性疾患に対する新しい治療戦略としての可能性を拓くものです.今後の課題としては,以下のようになるのではないかと思います.
①ムチン型O-グリコシル化を標的とした治療開発(とくにAAV遺伝子治療)
②グリコカリックスの維持・修復に関与する食事,運動,代謝因子などの解明
③その他の疾患(神経変性疾患,神経免疫疾患,脳血管疾患など)におけるグリコカリックス減少の影響と治療の可能性
とくに③については,どんどん報告が出てくるのではないかと思われます.さらに神経疾患の治療は面白い時代に入ってきたと思います.
Shi SM, et al. Glycocalyx dysregulation impairs blood-brain barrier in ageing and disease. Nature. 2025 Feb 26.(doi.org/10.1038/s41586-025-08589-9)

まずマウスを用いて加齢や神経変性疾患がグリコカリックスにどのような影響を与えるかを検討しています.電子顕微鏡を用いた観察により,若齢マウス(3カ月齢)では脳血管の内皮細胞に厚いグリコカリックス層(0.540 ± 0.086 µm)が存在するのに対し,老齢マウス(21カ月齢)ではこの層が顕著に薄くなり(0.232 ± 0.092 µm),グリコカリックスの占める面積比も低下(0.367 ± 0.054 → 0.207 ± 0.047)していることが明らかになりました(図2).

さらに,グリコカリックスにおいて重要な「ムチン型O-グリコシル化(mucin-type O-glycosylation)*」が特に低下していることが,RNAシーケンス解析によって確認されました.例えば,この減少に係るC1GALT1遺伝子の発現は加齢によって50%以上低下し,B3GNT3遺伝子も有意に減少していました.この変化は,アルツハイマー病やハンチントン病の患者脳においても共通して見られ,神経疾患におけるBBB機能不全の原因の一つである可能性が示唆されました.
*SerまたはThr残基にO-結合型で糖鎖が付加されるグリコシル化の一種で,特にムチンと呼ばれる高分子糖タンパク質に特徴的な修飾のこと.
つぎにムチン型O-グリコシル化を特異的に分解する酵素「StcE」を用いた実験を行っています.若齢マウスにこの酵素を投与すると,グリコカリックスが急激に破壊され,BBBの透過性が著しく増加することが分かりました.さらにC1GALT1のノックダウンを行っても,BBBの透過性が亢進し,血液成分が脳内に漏れ出し,最終的には脳出血まで引き起こされました(図3).特に,StcEを48時間持続的に投与したマウスでは,BBBのバリア機能が完全に破綻し,脳出血が発生しました.その影響は顕著で,脳内の血管透過性を示すSulfo-NHS-biotinトレーサーの漏出量が約3倍に増加しました.

次に,この異常を修復することでBBBの機能が回復するかどうかを検証するため,C1GALT1とB3GNT3をアデノ随伴ウイルス(AAV)を用いてマウス脳血管に導入しました.この結果,ムチン型O-グリコシル化が回復し,BBBの透過性が改善し,血液成分の漏れが顕著に減少しました.具体的にはトレーサーの漏出量が 50%以上抑制されました.さらに,この処置によって神経炎症が抑制され,認知機能が向上することも確認されました.特にB3GNT3の過剰発現は,老化に伴う神経細胞の遺伝子発現変化を若齢状態に近づける効果を示し,Y迷路テストでは 20%以上のスコア向上,恐怖条件付けテストでは 40%以上の記憶改善が見られました.
本研究のポイントは,BBB機能不全における新たな治療標的としてグリコカリックス,特にムチン型O-グリコシル化が重要であることを示した点です.これまでBBBの機能破綻は,BBBを構成する細胞やタイトジャンクションの異常が主な原因として考えられてきましたが,本研究はグリコカリックスがその根本的な要因の一つであることを示したものです(図4).

さらに,AAVを用いた遺伝子治療がBBBの機能回復に有効であることを示唆しており,アルツハイマー病などの神経変性疾患に対する新しい治療戦略としての可能性を拓くものです.今後の課題としては,以下のようになるのではないかと思います.
①ムチン型O-グリコシル化を標的とした治療開発(とくにAAV遺伝子治療)
②グリコカリックスの維持・修復に関与する食事,運動,代謝因子などの解明
③その他の疾患(神経変性疾患,神経免疫疾患,脳血管疾患など)におけるグリコカリックス減少の影響と治療の可能性
とくに③については,どんどん報告が出てくるのではないかと思われます.さらに神経疾患の治療は面白い時代に入ってきたと思います.
Shi SM, et al. Glycocalyx dysregulation impairs blood-brain barrier in ageing and disease. Nature. 2025 Feb 26.(doi.org/10.1038/s41586-025-08589-9)

























