今回のキーワードは,long COVID患者由来の自己抗体を注射したマウスにlong COVIDの症状が再現された!COVID-19感染後,虚血性脳卒中,アルツハイマー病,パーキンソン病の発症リスクは増加する,COVID-19感染後のパーキンソン病の発症リスクには神経炎症が関与している,抗ウイルス薬リトナビルの15日間内服はlong COVIDに無効であった,COVID-19後の認知機能障害の機序にIL-1βが関与し,ワクチン接種は発症リスクを軽減する,です.
世界ではCOVID-19の脳への影響が注目されています.神経・血管における炎症を引き起こし,long COVID(疲労やブレインフォグ)を起こすだけでなく,脳梗塞,血管性認知症,アルツハイマー病,パーキンソン病発症の危険因子となります.今回,パーキンソン病のモデル動物にSARS-CoV-2ウイルスを感染させたところ,αシヌクレイン病態が促進されることが示されました.また治療として期待された抗ウイルス薬リトナビルの長期投与はまったく無効であることも報告されました.同様に持続感染を標的とする臨床試験が複数進行中ですが,期待できないのかもしれません.最後にCOVID-19後の認知障害の機序として,サイトカインIL-1βにより海馬の神経新生が阻害されることが明らかにされましたが,嬉しいことにこれはワクチン接種で抑制されました.まとめるとCOVID-19後の神経障害を抑える治療は今のところワクチン接種しかないという結論になります.認知機能の低下は検査でもしない限りなかなか自分では気が付きません.科学的根拠の基づくワクチン接種の有用性を多くの人に知っていただきたいと思います.
◆long COVID患者由来の自己抗体を注射したマウスにlong COVIDの症状が再現された!
SARS-CoV-2ウイルス感染は,軽症感染でも,多様で機能的な自己抗体を生成する.米国Yale大学から,21,000のヒトタンパク質を含むHuProtヒトプロテオームアレイを用いて,long COVID(LC)患者の症状と相関する自己抗体の標的を検討した研究が報告された.神経症状の強いLC患者55人,回復期対照42人,非感染対照39人を比較した.結果として,まず神経系のタンパク質に対する自己抗体の増加は,神経症状を有するLC患者で認められた.これらの患者から精製したIgGは,免疫染色ではヒト橋などと反応し(図1),さらにマウスの坐骨神経,髄膜,小脳とも反応した.LC患者のIgGは脳の様々な部位を染色し,何人かの患者は,複数の中枢神経領域を染色した.上述のヒトプロテオームアレイの解析では,自己免疫疾患で知られる自己抗原だけでなく,中枢神経に発現する多様な抗原に反応する自己抗体が多かった.マウス坐骨神経および髄膜に反応する抗体は,患者の頭痛および見当識障害と相関していた.

つぎに患者から精製したIgGを健常マウスに受動移入し,行動分析を行った.最も顕著な表現型は,熱に対する疼痛感受性が亢進(反応するまでの時間が短縮)していたマウスで,神経障害性疼痛を有するLC患者からのIgGを投与されていた(図2).

握力が低下したマウスのほとんどは,頭痛患者由来のIgGを投与されていた.同様に,ロータロッド試験でバランスの障害を示したマウスは,めまいを有する患者のIgGを注射されていた.最後に疼痛感受性の機序を調べる目的で,皮内神経線維の数と量を測定したところ,IgGを投与されたマウスは,small fiber neuropathyのマーカーであるIENFが急速に減少した.以上より,自己抗体がLC患者の一部に関与し,それを標的とする治療が有益である可能性が示された.
Guedes de Sa KS, et al. A causal link between autoantibodies and neurological symptoms in long COVID. medRxiv. June 19, 2024.(doi.org/10.1101/2024.06.18.24309100)
◆COVID-19感染後,虚血性脳卒中,アルツハイマー病,パーキンソン病の発症リスクは増加する.
既報の3つの論文からCOVID-19による脳血管障害および神経変性疾患のリスク増加を検討した小論文が報告された.COVID-19感染後6ヶ月間の虚血性脳卒中のリスクは2.8倍,12ヶ月間では2.7倍に増加した.神経変性疾患に関しては,6ないし12ヶ月後の相対危険度はアルツハイマー病で3程度で,入院と外来でほとんど変わらなかった(図3).またパーキンソン病も外来患者で相対危険度が2.5程度であった.神経炎症や酸化ストレス,アミロイド形成などが神経変性のメカニズムとして推測された.
Bonhenry D, et al. SARS-CoV-2 infection as a cause of neurodegeneration. Lancet Neurol. 2024 Jun;23(6):562-563.(doi.org/10.1016/S1474-4422(24)00178-9)

◆COVID-19感染後のパーキンソン病の発症リスクには神経炎症が関与している.
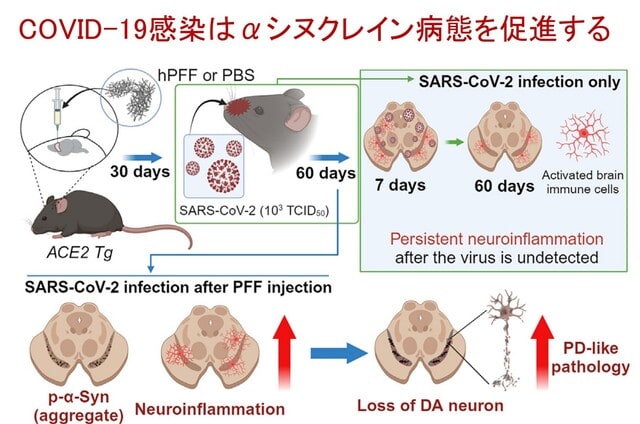
SARS-CoV-2ウイルス感染がパーキンソン病(PD)の進行に及ぼす影響については不明である.韓国から,ヒト胚性幹細胞(hESC)由来のドーパミン作動性(DA)ニューロンとヒトACE2(hACE2)Tgマウスモデルを用いて,SARS-CoV-2ウイルス感染がPD発症リスクを高めることを示した研究が報告された.具体的には,SARS-CoV-2ウイルス感染は,ヒトαシヌクレインpreformed fibrils(hPFFs)で前処理したDAニューロンの細胞死を悪化させた.さらに,SARS-CoV-2ウイルスの経鼻感染はhACE2 Tgマウスの脳内に伝播し,DAニューロンにまで感染が及び,hPFFによる障害を悪化させた(図4).SARS-CoV-2ウイルスに感染したマウスは,ウイルスが脳内で検出されなくなった後も,60日以上にわたって神経炎症の長期化をもたらした.包括的な解析から,アストロサイトとミクログリアによる炎症反応が,PD発症感受性に寄与している可能性が示唆された.
Lee B, et al. SARS-CoV-2 infection exacerbates the cellular pathology of Parkinson's disease in human dopaminergic neurons and a mouse model. Cell Rep Med. 2024 May 10:101570.(doi.org/10.1016/j.xcrm.2024.101570)
◆抗ウイルス薬リトナビルの15日間内服はlong COVIDに無効であった.
米国スタンフォード大学から抗ウイルス薬リトナビル(300mgと100mg)の15日間経口内服によるPASC(=long COVID)への効果を検証した研究が報告された.15週間の盲検プラセボ対照無作為化臨床試験である.主要評価項目は,10週時点における6つのPASC症状(疲労,ブレインフォグ,息切れ,体の痛み,消化器症状,心血管症状)の重症度の合計である.参加者155人(女性59%)のうち,102人がリトナビル群に,53人が偽薬群に割り付けられた(2:1).ほぼすべての参加者(n = 153)がワクチン接種を受けていた.結果として主要評価項目(図5),副次的評価項目とも有意差はなく,有害事象発生率も同程度であった.以上より,PASC患者におけるリトナビルの15日間コースは安全であることが示されたが,特定のPASC症状の改善に対する有益性は示されなかった.
Geng LN, et al. Nirmatrelvir-Ritonavir and Symptoms in Adults With Postacute Sequelae of SARS-CoV-2 Infection: The STOP-PASC Randomized Clinical Trial. JAMA Intern Med. 2024 Jun 7.(doi.org/10.1001/jamainternmed.2024.2007)

◆COVID-19後の認知機能障害の機序にIL-1βが関与し,ワクチン接種は発症リスクを軽減する.
SARS-CoV-2ウイルスに感染した人の最大25%が,感染後に認知機能障害を示す.このためCOVID-19に由来する記憶機能障害の症例は,世界中で数百万例にのぼると考えられている.米国からの研究で,認知機能障害のメカニズムとワクチン接種の効果を検討した研究が報告された.まずSARS-CoV-2ウイルス感染に対し,IL-1βはCOVID-19患者の海馬で上昇していた.C57BL/6JマウスにSARS-CoV-2β変異体を経鼻感染させると,脳内におけるウイルスの直接的な感染はなかったが,Ly6Chi単球(いわゆる炎症性単球)が浸潤し,ミクログリアも活性化していた.これらの細胞が神経炎症を引き起こすものと考えられた.炎症性サイトカインの産生,血液脳関門の障害,T細胞の浸潤も認められた.さらに研究では,SARS-CoV-2ウイルスが脳内IL-1βレベルを上昇させ,IL-1R1を介して海馬の神経新生の持続的な障害を誘導して認知障害を促進することが示された(この病態はH1N1インフルエンザウイルスでは認めなかった).最後に低用量のアデノウイルスベクターによるスパイクタンパク質のワクチン接種は,上述のSARS-CoV-2感染による海馬のIL-1β産生,神経新生の喪失,およびその後の記憶障害を予防することが示された.以上より,COVID-19による認知機能障害の機序にIL-1βが関与すること,ならびにワクチン接種がリスク軽減に寄与する可能性が示された.
Vanderheiden A, et al. Vaccination reduces central nervous system IL-1β and memory deficits after COVID-19 in mice. Nat Immunol (2024).(doi.org/10.1038/s41590-024-01868-z)

世界ではCOVID-19の脳への影響が注目されています.神経・血管における炎症を引き起こし,long COVID(疲労やブレインフォグ)を起こすだけでなく,脳梗塞,血管性認知症,アルツハイマー病,パーキンソン病発症の危険因子となります.今回,パーキンソン病のモデル動物にSARS-CoV-2ウイルスを感染させたところ,αシヌクレイン病態が促進されることが示されました.また治療として期待された抗ウイルス薬リトナビルの長期投与はまったく無効であることも報告されました.同様に持続感染を標的とする臨床試験が複数進行中ですが,期待できないのかもしれません.最後にCOVID-19後の認知障害の機序として,サイトカインIL-1βにより海馬の神経新生が阻害されることが明らかにされましたが,嬉しいことにこれはワクチン接種で抑制されました.まとめるとCOVID-19後の神経障害を抑える治療は今のところワクチン接種しかないという結論になります.認知機能の低下は検査でもしない限りなかなか自分では気が付きません.科学的根拠の基づくワクチン接種の有用性を多くの人に知っていただきたいと思います.
◆long COVID患者由来の自己抗体を注射したマウスにlong COVIDの症状が再現された!
SARS-CoV-2ウイルス感染は,軽症感染でも,多様で機能的な自己抗体を生成する.米国Yale大学から,21,000のヒトタンパク質を含むHuProtヒトプロテオームアレイを用いて,long COVID(LC)患者の症状と相関する自己抗体の標的を検討した研究が報告された.神経症状の強いLC患者55人,回復期対照42人,非感染対照39人を比較した.結果として,まず神経系のタンパク質に対する自己抗体の増加は,神経症状を有するLC患者で認められた.これらの患者から精製したIgGは,免疫染色ではヒト橋などと反応し(図1),さらにマウスの坐骨神経,髄膜,小脳とも反応した.LC患者のIgGは脳の様々な部位を染色し,何人かの患者は,複数の中枢神経領域を染色した.上述のヒトプロテオームアレイの解析では,自己免疫疾患で知られる自己抗原だけでなく,中枢神経に発現する多様な抗原に反応する自己抗体が多かった.マウス坐骨神経および髄膜に反応する抗体は,患者の頭痛および見当識障害と相関していた.

つぎに患者から精製したIgGを健常マウスに受動移入し,行動分析を行った.最も顕著な表現型は,熱に対する疼痛感受性が亢進(反応するまでの時間が短縮)していたマウスで,神経障害性疼痛を有するLC患者からのIgGを投与されていた(図2).

握力が低下したマウスのほとんどは,頭痛患者由来のIgGを投与されていた.同様に,ロータロッド試験でバランスの障害を示したマウスは,めまいを有する患者のIgGを注射されていた.最後に疼痛感受性の機序を調べる目的で,皮内神経線維の数と量を測定したところ,IgGを投与されたマウスは,small fiber neuropathyのマーカーであるIENFが急速に減少した.以上より,自己抗体がLC患者の一部に関与し,それを標的とする治療が有益である可能性が示された.
Guedes de Sa KS, et al. A causal link between autoantibodies and neurological symptoms in long COVID. medRxiv. June 19, 2024.(doi.org/10.1101/2024.06.18.24309100)
◆COVID-19感染後,虚血性脳卒中,アルツハイマー病,パーキンソン病の発症リスクは増加する.
既報の3つの論文からCOVID-19による脳血管障害および神経変性疾患のリスク増加を検討した小論文が報告された.COVID-19感染後6ヶ月間の虚血性脳卒中のリスクは2.8倍,12ヶ月間では2.7倍に増加した.神経変性疾患に関しては,6ないし12ヶ月後の相対危険度はアルツハイマー病で3程度で,入院と外来でほとんど変わらなかった(図3).またパーキンソン病も外来患者で相対危険度が2.5程度であった.神経炎症や酸化ストレス,アミロイド形成などが神経変性のメカニズムとして推測された.
Bonhenry D, et al. SARS-CoV-2 infection as a cause of neurodegeneration. Lancet Neurol. 2024 Jun;23(6):562-563.(doi.org/10.1016/S1474-4422(24)00178-9)

◆COVID-19感染後のパーキンソン病の発症リスクには神経炎症が関与している.
SARS-CoV-2ウイルス感染がパーキンソン病(PD)の進行に及ぼす影響については不明である.韓国から,ヒト胚性幹細胞(hESC)由来のドーパミン作動性(DA)ニューロンとヒトACE2(hACE2)Tgマウスモデルを用いて,SARS-CoV-2ウイルス感染がPD発症リスクを高めることを示した研究が報告された.具体的には,SARS-CoV-2ウイルス感染は,ヒトαシヌクレインpreformed fibrils(hPFFs)で前処理したDAニューロンの細胞死を悪化させた.さらに,SARS-CoV-2ウイルスの経鼻感染はhACE2 Tgマウスの脳内に伝播し,DAニューロンにまで感染が及び,hPFFによる障害を悪化させた(図4).SARS-CoV-2ウイルスに感染したマウスは,ウイルスが脳内で検出されなくなった後も,60日以上にわたって神経炎症の長期化をもたらした.包括的な解析から,アストロサイトとミクログリアによる炎症反応が,PD発症感受性に寄与している可能性が示唆された.
Lee B, et al. SARS-CoV-2 infection exacerbates the cellular pathology of Parkinson's disease in human dopaminergic neurons and a mouse model. Cell Rep Med. 2024 May 10:101570.(doi.org/10.1016/j.xcrm.2024.101570)

◆抗ウイルス薬リトナビルの15日間内服はlong COVIDに無効であった.
米国スタンフォード大学から抗ウイルス薬リトナビル(300mgと100mg)の15日間経口内服によるPASC(=long COVID)への効果を検証した研究が報告された.15週間の盲検プラセボ対照無作為化臨床試験である.主要評価項目は,10週時点における6つのPASC症状(疲労,ブレインフォグ,息切れ,体の痛み,消化器症状,心血管症状)の重症度の合計である.参加者155人(女性59%)のうち,102人がリトナビル群に,53人が偽薬群に割り付けられた(2:1).ほぼすべての参加者(n = 153)がワクチン接種を受けていた.結果として主要評価項目(図5),副次的評価項目とも有意差はなく,有害事象発生率も同程度であった.以上より,PASC患者におけるリトナビルの15日間コースは安全であることが示されたが,特定のPASC症状の改善に対する有益性は示されなかった.
Geng LN, et al. Nirmatrelvir-Ritonavir and Symptoms in Adults With Postacute Sequelae of SARS-CoV-2 Infection: The STOP-PASC Randomized Clinical Trial. JAMA Intern Med. 2024 Jun 7.(doi.org/10.1001/jamainternmed.2024.2007)

◆COVID-19後の認知機能障害の機序にIL-1βが関与し,ワクチン接種は発症リスクを軽減する.
SARS-CoV-2ウイルスに感染した人の最大25%が,感染後に認知機能障害を示す.このためCOVID-19に由来する記憶機能障害の症例は,世界中で数百万例にのぼると考えられている.米国からの研究で,認知機能障害のメカニズムとワクチン接種の効果を検討した研究が報告された.まずSARS-CoV-2ウイルス感染に対し,IL-1βはCOVID-19患者の海馬で上昇していた.C57BL/6JマウスにSARS-CoV-2β変異体を経鼻感染させると,脳内におけるウイルスの直接的な感染はなかったが,Ly6Chi単球(いわゆる炎症性単球)が浸潤し,ミクログリアも活性化していた.これらの細胞が神経炎症を引き起こすものと考えられた.炎症性サイトカインの産生,血液脳関門の障害,T細胞の浸潤も認められた.さらに研究では,SARS-CoV-2ウイルスが脳内IL-1βレベルを上昇させ,IL-1R1を介して海馬の神経新生の持続的な障害を誘導して認知障害を促進することが示された(この病態はH1N1インフルエンザウイルスでは認めなかった).最後に低用量のアデノウイルスベクターによるスパイクタンパク質のワクチン接種は,上述のSARS-CoV-2感染による海馬のIL-1β産生,神経新生の喪失,およびその後の記憶障害を予防することが示された.以上より,COVID-19による認知機能障害の機序にIL-1βが関与すること,ならびにワクチン接種がリスク軽減に寄与する可能性が示された.
Vanderheiden A, et al. Vaccination reduces central nervous system IL-1β and memory deficits after COVID-19 in mice. Nat Immunol (2024).(doi.org/10.1038/s41590-024-01868-z)


























