今回のキーワードは,血清コルチゾールはlong COVIDの最も有力な予測因子である,SARS-CoV-2ウイルスは海馬・延髄の血液脳関門破綻につづく神経炎症と神経新生障害を来たし,認知症をもたらす,SARS-CoV-2ウイルスは形態的にも血液脳関門の変化をもたらす,です.
Long COVIDの病態機序に大きな進展がありました.脳には「血液脳関門」という,血液からの病原体や有害物質の侵入に対するバリア機構が存在します.SARS-CoV-2ウイルスはこの血液脳関門を壊してしまい,血中のサイトカインや細胞が脳内に入り,脳に炎症を起こし,記憶にかかわる神経細胞の新生を妨げることが示されました.さらに脳により制御され副腎から分泌される重要なホルモン,コルチゾールが,健常者の半分まで低下してしまい,疲労感などの症状を引き起こすことも初めて示されました.多くの人はまだ理解していませんが,脳に対する影響が大きい,巧妙で厄介なウイルスです.対する人間サイドは十分に科学的議論をすることなく,療養期間の短縮を決めてしまいました.いままでにも何度も書きましたが,この難敵には科学的に立ち向かう必要があります.科学も刻々と進歩しています.専門家は最新の情報をupdateし,国民に啓発し,政府は専門家の意見に真摯に耳を傾け,COVID-19による死者や社会に復帰できない人を最小限に抑え,国民を守る務めがあると思います.
◆血清コルチゾールはlong COVIDの最も有力な予測因子である.
Long COVIDの病態機序を解明するために,long COVIDを識別する検査データを検討した横断研究が米国から報告された.対象は健常・非感染(HC群)40人,健常・未ワクチン接種・既感染(HCW群)37人,健常・既感染・持続症状なし(CC群)39人,感染後持続症状あり(LC群=long COVID)99人の合計215人である.結果として,感染後400日以上経過した時点で,3つの対照群と比較して,LC群では特定の骨髄球およびリンパ球の集団に顕著な違いが認められ,またSARS-CoV-2ウイルスに対する抗体反応の上昇が確認された.またSARS-CoV-2ウイルス以外のウイルス,とくにEpstein-Barrウイルスに対する抗体反応の予想外の増加が認められた.一方,ヒトエキソプロテオームに対する自己抗体については群間で有意な差は認めなかった.さらに血清コルチゾール値が,LC群ではその他の対照群と比較して約半分に低下していた(中央値LC群47.01 ng/mL vs. HC群90.32 ng/mL vs. CC群82.67 ng/mL)(図 1).
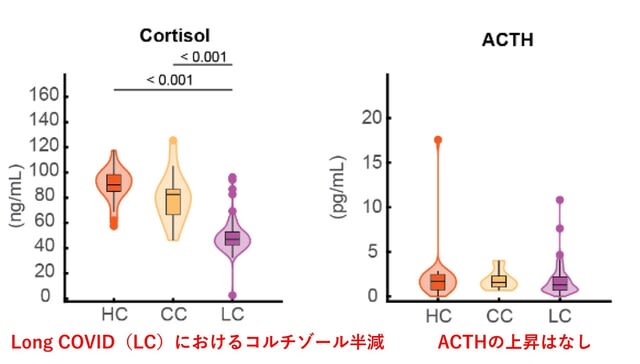
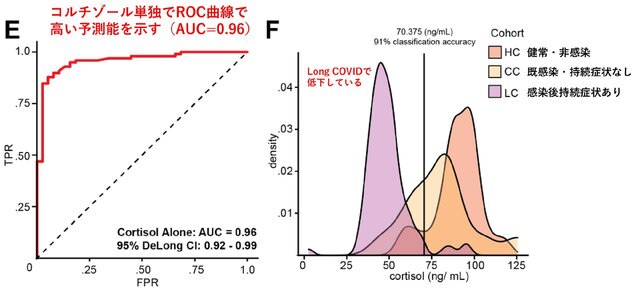
ACTH値は群間で差はなかった.つまり低コルチゾール血症はACTH値の有意な変動と関連せず,視床下部-下垂体axisによる代償反応が鈍化していると考えられた.機械学習モデルに基づくと,血清コルチゾールはlong COVIDの最も有力な予測因子であり,コルチゾール単独でROC曲線のAUC 0.96を達成した(図2左).コルチゾールは非感染の対照群(HC群)で最も高く,回復期の対照群(CC群)でやや低くなり,long COVID群LC群)で最も低かった(図2右).70.38 ng/mLの閾値で最大91.9%の分類精度を得た.
コルチゾールはストレス応答にかかわる重要なホルモンであり,その低下は易疲労などlong COVIDに類似した症状をもたらす.コルチゾール低下は筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)でも報告があり注目される.しかしコルチゾールは多様な病態で低下しうることからlong COVIDの診断に対して優れた特異性を維持できる可能性は低い.その代わりに本研究で同定された可溶性バイオマーカーの最小セット,コルチゾール減少,IL-8とガレクチン-1増加が特異的な診断バイオマーカーとして有益である可能性がある.
最後にlong COVIDの病因として,持続性ウイルス感染/ウイルス残骸,自己免疫,ディスバイオーシス,潜在性ウイルスの再活性化,修復されない組織障害,慢性炎症など,複数の仮説が提唱されてきた.今回のデータは,持続性抗原の存在,潜在性ウイルスの再活性化,慢性炎症の関与を示唆するもので,自己抗体説の可能性は低くなったと考えられる.
→ N=100とやや少ないものの,ありとあらゆる項目を徹底的に検討し,データも膨大で圧倒された.米国が総力を上げてlong COVIDに取り組んだ成果である.畏敬の念を抱かせる素晴らしい論文.
medRxiv. Aug 10, 2022.(doi.org/10.1101/2022.08.09.22278592)
◆SARS-CoV-2ウイルスは海馬・延髄の血液脳関門破綻につづく神経炎症と神経新生障害を来たし,認知症をもたらす.
SARS-CoV-2ウイルス感染後の神経精神症状のメカニズムを動物モデル,ヒト剖検脳を用いて病理学的に検討した研究が米国ワシントン大学から報告された.まずSARS-CoV-2ウイルスを鼻腔内感染させたハムスターを用いて,血液脳関門の透過性が亢進(=破綻)しているにもかかわらず,ウイルスは脳実質には認めず,脳内に侵入しないことを示した.血液脳関門の透過性亢進の原因として,IFNγおよびIL-6が原因であるという仮説をたて,感染ハムスターおよびCOVID-19で死亡した患者を対照と比較したところ,とくに海馬と延髄でIL-1βとIL-6の発現,およびミクログリアの活性化を見出した(図3).またIL-6とIL-1βは,海馬における抗神経新生作用がある.このため感染ハムスターとヒトの両方の海馬歯状回を検討し,増殖マーカーであるKi67と神経芽細胞や未熟な神経細胞のマーカーであるDCX(ダブルコルチン)を発現する細胞数が減少し,神経新生が抑制されていることを確認した.以上より「サイトカイン発現→血液脳関門破綻→サイトカインや免疫細胞の脳への侵入→ミクログリア活性化+神経新生障害→神経精神症状」というパスウェイが推測された.とくに海馬の障害は,COVID-19患者の学習,記憶,遂行機能障害を説明できる可能性がある.高齢者ではでは多能性前駆細胞プールが小さくなっているため,感染後,神経発生が生じるために十分な多能性前駆細胞が存在しない可能性があり,とくに認知症が生じやすいことを説明できるかもしれない.
Soung AL, et al. Brain, 2022;, awac270(doi.org/10.1093/brain/awac270)

◆SARS-CoV-2ウイルスは形態的にも血液脳関門の変化をもたらす.
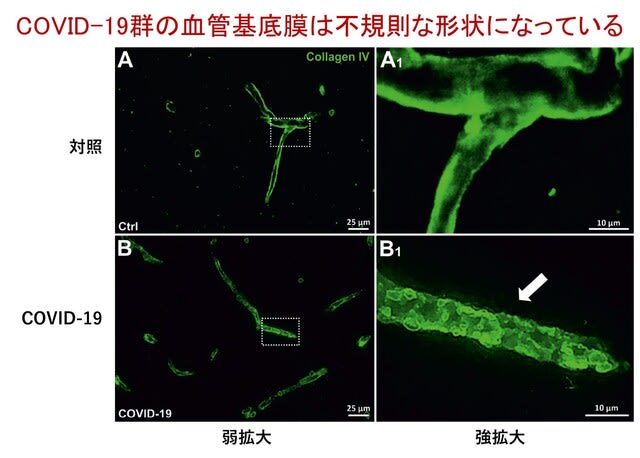
COVID-19患者14名の剖検脳を用いて血液脳関門を検討した研究がルーマニアから報告された.全例入院患者で,入院後0~24日で死亡した.3分の1の症例は何らかの神経症状を呈していた.方法としては,血管基底膜と血管周囲アストロサイトの形態を光学顕微鏡で解析し,コラーゲンIV(血管基底膜マーカー)とGFAP(アストロサイトマーカー),CD31(血管内皮マーカー),TJ1(密着結合),AQP4(水チャネル)を免疫組織学的に対照4名と比較した.この結果,GFAP陽性アストロサイトのフラクタル次元解析では,COVID-19患者において分枝の複雑さが減少し,GFAPと血管基底膜の骨格を成すコラーゲンIVの共局在が減少していた.興味深いことに,血管基底膜は対照群と比較して形態的な不規則性が増加していた(図4).またCOVID-19患者では血管径がとくに白質において増大し,TJ1の血管内皮との共局在が減少,さらにAQP4とアストロサイトの共局在が減少していた.以上より,COVID-19剖検脳では,血管基底膜の不規則性,血管内皮密着結合の消失,アストロサイト足突起の減少,AQP4の減少が認められ,血液脳関門の破綻が示された.
Eur J Neurol. 02 September 2022(doi.org/10.1111/ene.15545)
Long COVIDの病態機序に大きな進展がありました.脳には「血液脳関門」という,血液からの病原体や有害物質の侵入に対するバリア機構が存在します.SARS-CoV-2ウイルスはこの血液脳関門を壊してしまい,血中のサイトカインや細胞が脳内に入り,脳に炎症を起こし,記憶にかかわる神経細胞の新生を妨げることが示されました.さらに脳により制御され副腎から分泌される重要なホルモン,コルチゾールが,健常者の半分まで低下してしまい,疲労感などの症状を引き起こすことも初めて示されました.多くの人はまだ理解していませんが,脳に対する影響が大きい,巧妙で厄介なウイルスです.対する人間サイドは十分に科学的議論をすることなく,療養期間の短縮を決めてしまいました.いままでにも何度も書きましたが,この難敵には科学的に立ち向かう必要があります.科学も刻々と進歩しています.専門家は最新の情報をupdateし,国民に啓発し,政府は専門家の意見に真摯に耳を傾け,COVID-19による死者や社会に復帰できない人を最小限に抑え,国民を守る務めがあると思います.
◆血清コルチゾールはlong COVIDの最も有力な予測因子である.
Long COVIDの病態機序を解明するために,long COVIDを識別する検査データを検討した横断研究が米国から報告された.対象は健常・非感染(HC群)40人,健常・未ワクチン接種・既感染(HCW群)37人,健常・既感染・持続症状なし(CC群)39人,感染後持続症状あり(LC群=long COVID)99人の合計215人である.結果として,感染後400日以上経過した時点で,3つの対照群と比較して,LC群では特定の骨髄球およびリンパ球の集団に顕著な違いが認められ,またSARS-CoV-2ウイルスに対する抗体反応の上昇が確認された.またSARS-CoV-2ウイルス以外のウイルス,とくにEpstein-Barrウイルスに対する抗体反応の予想外の増加が認められた.一方,ヒトエキソプロテオームに対する自己抗体については群間で有意な差は認めなかった.さらに血清コルチゾール値が,LC群ではその他の対照群と比較して約半分に低下していた(中央値LC群47.01 ng/mL vs. HC群90.32 ng/mL vs. CC群82.67 ng/mL)(図 1).

ACTH値は群間で差はなかった.つまり低コルチゾール血症はACTH値の有意な変動と関連せず,視床下部-下垂体axisによる代償反応が鈍化していると考えられた.機械学習モデルに基づくと,血清コルチゾールはlong COVIDの最も有力な予測因子であり,コルチゾール単独でROC曲線のAUC 0.96を達成した(図2左).コルチゾールは非感染の対照群(HC群)で最も高く,回復期の対照群(CC群)でやや低くなり,long COVID群LC群)で最も低かった(図2右).70.38 ng/mLの閾値で最大91.9%の分類精度を得た.

コルチゾールはストレス応答にかかわる重要なホルモンであり,その低下は易疲労などlong COVIDに類似した症状をもたらす.コルチゾール低下は筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)でも報告があり注目される.しかしコルチゾールは多様な病態で低下しうることからlong COVIDの診断に対して優れた特異性を維持できる可能性は低い.その代わりに本研究で同定された可溶性バイオマーカーの最小セット,コルチゾール減少,IL-8とガレクチン-1増加が特異的な診断バイオマーカーとして有益である可能性がある.
最後にlong COVIDの病因として,持続性ウイルス感染/ウイルス残骸,自己免疫,ディスバイオーシス,潜在性ウイルスの再活性化,修復されない組織障害,慢性炎症など,複数の仮説が提唱されてきた.今回のデータは,持続性抗原の存在,潜在性ウイルスの再活性化,慢性炎症の関与を示唆するもので,自己抗体説の可能性は低くなったと考えられる.
→ N=100とやや少ないものの,ありとあらゆる項目を徹底的に検討し,データも膨大で圧倒された.米国が総力を上げてlong COVIDに取り組んだ成果である.畏敬の念を抱かせる素晴らしい論文.
medRxiv. Aug 10, 2022.(doi.org/10.1101/2022.08.09.22278592)
◆SARS-CoV-2ウイルスは海馬・延髄の血液脳関門破綻につづく神経炎症と神経新生障害を来たし,認知症をもたらす.
SARS-CoV-2ウイルス感染後の神経精神症状のメカニズムを動物モデル,ヒト剖検脳を用いて病理学的に検討した研究が米国ワシントン大学から報告された.まずSARS-CoV-2ウイルスを鼻腔内感染させたハムスターを用いて,血液脳関門の透過性が亢進(=破綻)しているにもかかわらず,ウイルスは脳実質には認めず,脳内に侵入しないことを示した.血液脳関門の透過性亢進の原因として,IFNγおよびIL-6が原因であるという仮説をたて,感染ハムスターおよびCOVID-19で死亡した患者を対照と比較したところ,とくに海馬と延髄でIL-1βとIL-6の発現,およびミクログリアの活性化を見出した(図3).またIL-6とIL-1βは,海馬における抗神経新生作用がある.このため感染ハムスターとヒトの両方の海馬歯状回を検討し,増殖マーカーであるKi67と神経芽細胞や未熟な神経細胞のマーカーであるDCX(ダブルコルチン)を発現する細胞数が減少し,神経新生が抑制されていることを確認した.以上より「サイトカイン発現→血液脳関門破綻→サイトカインや免疫細胞の脳への侵入→ミクログリア活性化+神経新生障害→神経精神症状」というパスウェイが推測された.とくに海馬の障害は,COVID-19患者の学習,記憶,遂行機能障害を説明できる可能性がある.高齢者ではでは多能性前駆細胞プールが小さくなっているため,感染後,神経発生が生じるために十分な多能性前駆細胞が存在しない可能性があり,とくに認知症が生じやすいことを説明できるかもしれない.
Soung AL, et al. Brain, 2022;, awac270(doi.org/10.1093/brain/awac270)

◆SARS-CoV-2ウイルスは形態的にも血液脳関門の変化をもたらす.
COVID-19患者14名の剖検脳を用いて血液脳関門を検討した研究がルーマニアから報告された.全例入院患者で,入院後0~24日で死亡した.3分の1の症例は何らかの神経症状を呈していた.方法としては,血管基底膜と血管周囲アストロサイトの形態を光学顕微鏡で解析し,コラーゲンIV(血管基底膜マーカー)とGFAP(アストロサイトマーカー),CD31(血管内皮マーカー),TJ1(密着結合),AQP4(水チャネル)を免疫組織学的に対照4名と比較した.この結果,GFAP陽性アストロサイトのフラクタル次元解析では,COVID-19患者において分枝の複雑さが減少し,GFAPと血管基底膜の骨格を成すコラーゲンIVの共局在が減少していた.興味深いことに,血管基底膜は対照群と比較して形態的な不規則性が増加していた(図4).またCOVID-19患者では血管径がとくに白質において増大し,TJ1の血管内皮との共局在が減少,さらにAQP4とアストロサイトの共局在が減少していた.以上より,COVID-19剖検脳では,血管基底膜の不規則性,血管内皮密着結合の消失,アストロサイト足突起の減少,AQP4の減少が認められ,血液脳関門の破綻が示された.
Eur J Neurol. 02 September 2022(doi.org/10.1111/ene.15545)


























