進行性核上性麻痺(PSP)や大脳皮質基底核変性症(CBD)は,アミロイドβも関わるアルツハイマー病とは異なり,タウのみが病態に関わる「純粋な」タウオパチーと考えられてきました.しかし近年,αシヌクレイン(αSyn)も関与しうる可能性が示唆されています.今回,トロント大を中心とする研究チームから,αシヌクレインシード増幅アッセイ(αSyn-SAA)を行い,PSPおよび大脳皮質基底核症候群(CBS)患者におけるαシヌクレイン共存の意義を検討した研究がNeurology誌に報告されました.
対象となった68名(PSP 28名,CBS 40名)のうち,PSP患者の28.6%,CBS患者の35.9%がαSyn-SAA陽性でした.また興味深いことに,若年発症の患者においては,アルツハイマー病(AD)のバイオマーカー陽性(アミロイドβ42の低下など)とαSyn-SAA陽性との強い関連が見られました.
図1Aでは,若年発症(65歳未満)と高齢発症(65歳以上)に分けて,ADバイオマーカー(特に脳脊髄液Aβ42の低下)とαSyn-SAA陽性の関連を示しています.若年発症群では,ADバイオマーカー陽性患者のうち56%がαSyn-SAA陽性であり,ADバイオマーカー陰性だとαSyn-SAA陽性も12%と小さくなることが分かります.しかし高齢になると,AD病理と無関係にαシヌクレイン病理が陽性になることが示唆されます(ADバイオマーカー陰性でもαSyn-SAA陽性が46%と上昇している).

図1Bは,発症年齢と脳脊髄液中Aβ42の関連を示しています.αSyn-SAA陽性の患者では(オレンジ),若くなるほどAβ42レベルが低下しており,AD病理との関連が示唆されます.一方,αSyn-SAA陰性の患者では,発症年齢とAβ42には関連が見られません.
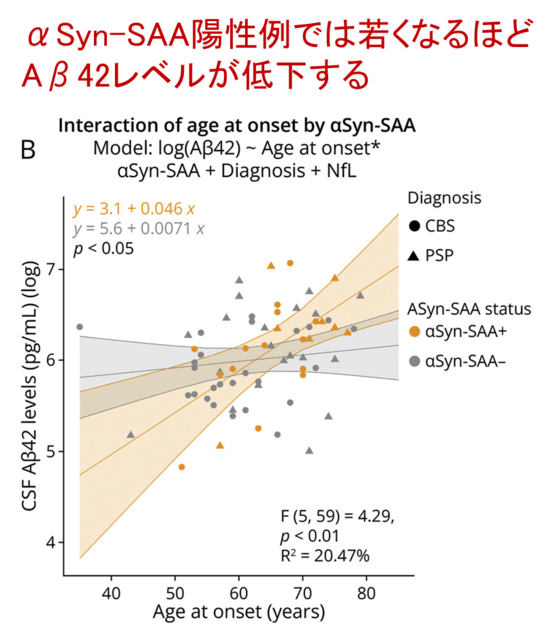
図1Cは,CBSおよびPSP患者の主要な臨床症候(振戦,安静時振戦,筋強剛,運動緩慢,失効,歩行障害,転倒,眼球運動障害)を,αSyn-SAA陽性と陰性で比較したものですが,大きな差は認めませんでした.ただしREM睡眠行動障害の既往は,αSyn-SAA陽性と強く関連していました(オッズ比60.2!,p < 0.01).PSPではRBDを合併しうることは有名でしたが,このような症例はαSyn-SAA陽性である可能性が高いことを意味し,個人的には驚きました.
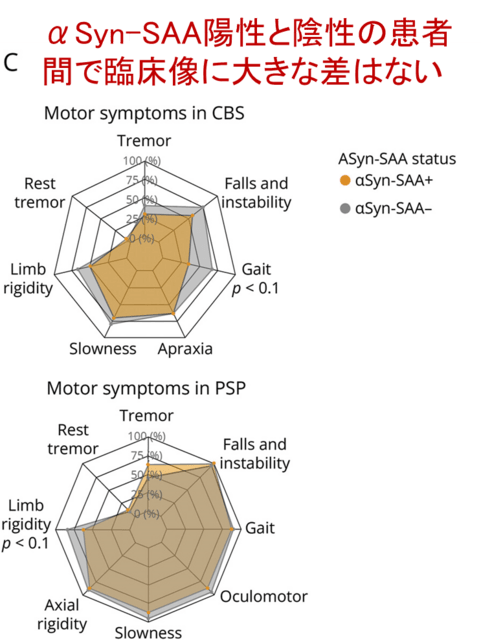
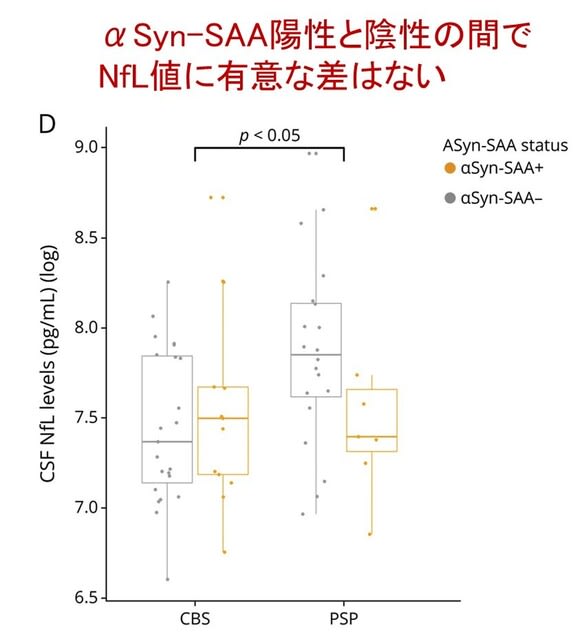
図1Dは,神経細胞障害の指標であるNfL値を比較したもので,PSPの方がCBSよりも高い傾向がありますが,αSyn-SAA陽性と陰性の間で有意な差はなく,αSyn病理の合併が神経変性を促進するというわけではないものと考えられました.
以上より,αSyn病理の合併はCBSやPSPでは少なくないこと,αSyn病理の合併で大きく症候は修飾されないが,αSyn陽性例でRBDを呈しうること,若年発症例ではαSyn病理にAD病理が関連する可能性があることが分かりました.そしてこの論文は将来の治療において重要な意義を持つ可能性があります.最初に記載したとおり,これまでPSP/CBSはアルツハイマー病とは異なる「純粋な」タウオパチーであるため,TilavonemabやGosuranemabといった抗タウ抗体による治験が行われ,いずれも失敗したという経緯がありました.今後,αSyn-SAA等のバイオマーカーや年齢を用いて,対象患者を層別化し,ターゲットを絞ることが求められるかもしれません.また神経変性疾患における複数の病理(タウ,αシヌクレイン,βアミロイド)の複雑な相互作用を解明する必要性を感じました.
Anastassiadis C, et al. CSF α-Synuclein Seed Amplification Assay in Patients With Atypical Parkinsonian Disorders. Neurology. 2024 Sep 24;103(6):e209818.(doi.org/10.1212/WNL.0000000000209818)
対象となった68名(PSP 28名,CBS 40名)のうち,PSP患者の28.6%,CBS患者の35.9%がαSyn-SAA陽性でした.また興味深いことに,若年発症の患者においては,アルツハイマー病(AD)のバイオマーカー陽性(アミロイドβ42の低下など)とαSyn-SAA陽性との強い関連が見られました.
図1Aでは,若年発症(65歳未満)と高齢発症(65歳以上)に分けて,ADバイオマーカー(特に脳脊髄液Aβ42の低下)とαSyn-SAA陽性の関連を示しています.若年発症群では,ADバイオマーカー陽性患者のうち56%がαSyn-SAA陽性であり,ADバイオマーカー陰性だとαSyn-SAA陽性も12%と小さくなることが分かります.しかし高齢になると,AD病理と無関係にαシヌクレイン病理が陽性になることが示唆されます(ADバイオマーカー陰性でもαSyn-SAA陽性が46%と上昇している).

図1Bは,発症年齢と脳脊髄液中Aβ42の関連を示しています.αSyn-SAA陽性の患者では(オレンジ),若くなるほどAβ42レベルが低下しており,AD病理との関連が示唆されます.一方,αSyn-SAA陰性の患者では,発症年齢とAβ42には関連が見られません.

図1Cは,CBSおよびPSP患者の主要な臨床症候(振戦,安静時振戦,筋強剛,運動緩慢,失効,歩行障害,転倒,眼球運動障害)を,αSyn-SAA陽性と陰性で比較したものですが,大きな差は認めませんでした.ただしREM睡眠行動障害の既往は,αSyn-SAA陽性と強く関連していました(オッズ比60.2!,p < 0.01).PSPではRBDを合併しうることは有名でしたが,このような症例はαSyn-SAA陽性である可能性が高いことを意味し,個人的には驚きました.

図1Dは,神経細胞障害の指標であるNfL値を比較したもので,PSPの方がCBSよりも高い傾向がありますが,αSyn-SAA陽性と陰性の間で有意な差はなく,αSyn病理の合併が神経変性を促進するというわけではないものと考えられました.

以上より,αSyn病理の合併はCBSやPSPでは少なくないこと,αSyn病理の合併で大きく症候は修飾されないが,αSyn陽性例でRBDを呈しうること,若年発症例ではαSyn病理にAD病理が関連する可能性があることが分かりました.そしてこの論文は将来の治療において重要な意義を持つ可能性があります.最初に記載したとおり,これまでPSP/CBSはアルツハイマー病とは異なる「純粋な」タウオパチーであるため,TilavonemabやGosuranemabといった抗タウ抗体による治験が行われ,いずれも失敗したという経緯がありました.今後,αSyn-SAA等のバイオマーカーや年齢を用いて,対象患者を層別化し,ターゲットを絞ることが求められるかもしれません.また神経変性疾患における複数の病理(タウ,αシヌクレイン,βアミロイド)の複雑な相互作用を解明する必要性を感じました.
Anastassiadis C, et al. CSF α-Synuclein Seed Amplification Assay in Patients With Atypical Parkinsonian Disorders. Neurology. 2024 Sep 24;103(6):e209818.(doi.org/10.1212/WNL.0000000000209818)

























