
彦根藩二代当主である井伊直孝公をお寺の門前で手招き雷雨から救ったと
伝えられる招き猫と、井伊軍団のシンボルとも言える赤備え(戦国時代の
井伊軍団編成の一種、あらゆる武具を朱りにした部隊編成のこと)と兜(
かぶと)を合体させて生まれたキャラクタ。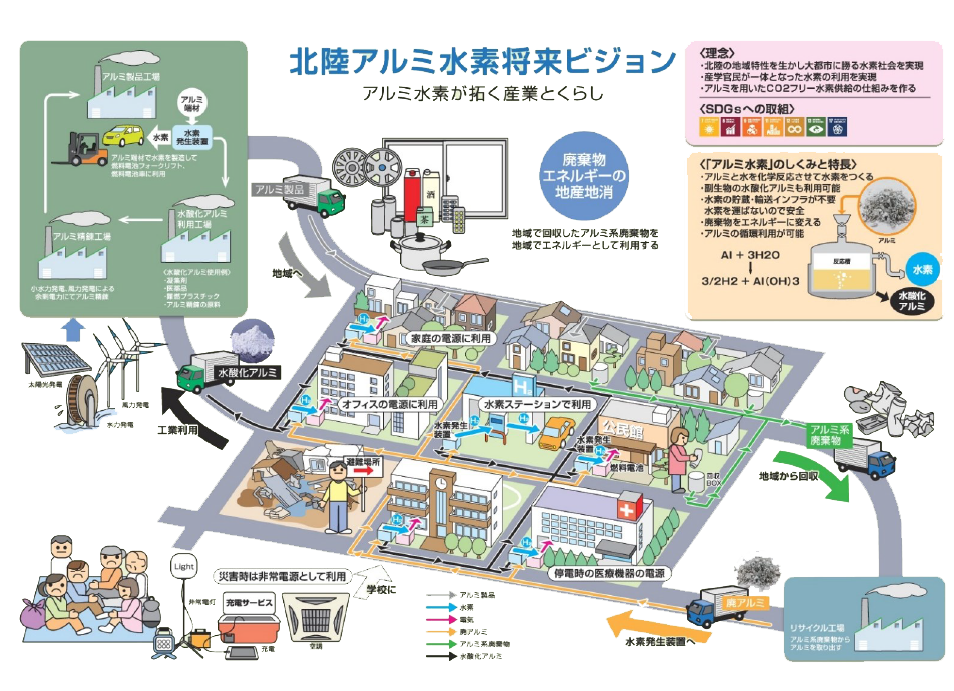
✅ 新エネルギー便り:耐久性50年を目指す 😁⛑️


🎈液晶パネルや感光体の技術も結集、シャープのペロブスカイト太陽電池
✳️ アルミ廃棄物で水素製造の反応液開発
Development of Reaction Liquid in Hydrogen Generation Using Aluminum Based Waste
Nobuaki Mizukia,*, Wataru Mizunoa, Kiyoshi Kawaguchib
(Received October 28, 2019; revised December 25, 2019; accepted February 5, 2020)
キーワード:アルミ付き紙系廃棄物,アルミ,水素,水酸化ナトリウム,無機塩
Keywords : Paper-based waste with aluminum, Aluminum, Hydrogen, NaOH, Inorganic salt
1. はじめに
日本はエネルギーや資源に乏しいため,それらを輸入して工業製品を生産
し,国内で消費するとともに外国に輸出しているが,エネルギーフローと
物質フローを考えた場合,大きな問題点を抱えている。
エネルギーフローでは,入口問題として石油や天然ガス等のエネルギー価
格の高騰が挙げられる。また,出口問題として化石燃料を燃料とした火力
発電や自動車の使用による二酸化炭素濃度の増加と,それに伴う地球温暖
化が挙げられる。地球温暖化は台風の大型化や発生頻度の増大,降雨量の
増大等の異常気象を引き起こす要因の一つと考えられるため,二酸化炭素
の発生を抑制できる代替エネルギーの積極的な利用が期待される。
一方の物質フローでは,入口問題として工業用原料となる資源価格の高騰
が挙げられる。とくに建築用や包装用材料等として重要なアルミニウムの
価格は上昇する傾向にある。また,出口問題としては,家庭用や産業用廃
棄物の増加と,廃棄物を焼却したり埋め立てたりする処理能力の減少があ
る。これらのエネルギーフローと物質フローにおける問題の解決こそが,
日本における緊急の重要課題である。
食品・錠剤の包装に使用されるアルミニウム(アルミ箔)は年間15万トン
程度(アルミ最終需要の3.5%)であるが,その薄さゆえにアルミとして回
収は不可能であり,焼却処分や埋め立て処分されている(リサイクル率は
ほぼゼロ)。またこれまでの調査で,一般家庭の燃えるゴミの1割程度が
アルミ系廃棄物であることが分かっている。しかしアルミは低融点であり,
アルミ系廃棄物からアルミ分を回収することは困難と見られていた。
廃アルミの有効利用に関する先行研究としては,アルミドロスからの水素
生産システムがあるが,アルミドロスの品質やアルミ産業の立地依存とい
う課題がある。
その中で,アルミと水酸化ナトリウム水溶液を反応させることによって水
素を発生させる研究例は報告されている(5)~(8)が,水酸化ナトリウム水
溶液に添加物を混ぜることによって,水素発生速度を増大させる研究例は
殆どない。
そこで本研究では,アルミと反応させて水素を発生させる反応液として,
水酸化ナトリウム水溶液に様々な無機塩類を添加することによって,水素
発生速度や水素の収率を向上できる反応液を開発したので報告する。
2. 実験装置と方法
2.1 実験材料
実験に用いたアルミニウムは,市販アルミホイル(純度:99%以上,厚さ
:11μm)を15mm角程度の不定形にちぎり使用した。図1に使用したアル
ミを示す。
試薬には,NaOH,アルミン酸ナトリウム,Fe2(SO4)3・nH2O,FeSO4
・7H2O,CuSO4・5H2O,MgSO4,Na2SO4,FeCl2・4H2O,FeCl3・
6H2O,CuCl2・2H2O,CuCl,MgCl2・6H2O,NaCl,二りん酸鉄(Ⅲ),
Na2HPO4,Na3PO4・12H2Oを使用した。この際,アルミン酸ナトリウ
ム,二りん酸鉄(Ⅲ)はJIS試薬1級を用いたが,他の試薬はJIS試薬特級を
使用した。
2.2 実験装置
パイレックスガラス器具およびシリコンゴム管を用いて図2に示す様な
実験装置を作製した。反応槽の内容積は500mlである。反応時の,反応槽
下部(反応液),反応槽上部(発生ガス),気温,反応槽バス,捕集管バ
スの温度を温度センサーを用いて計測し,データロガーを用いてデータ収
集を行った。反応槽バス,捕集管バスは30℃となるようにヒーターにより
加温した。反応溶液のpHを,pHメーターで計測した。
2.2 実験方法
(1)NaOH濃度と水素発生
NaOH濃度と水素発生速度や水素発生量との関係に関する基礎的なデータ
を得るため,濃度を変えたNaOH水溶液の水素発生状態を評価した。1~5
%(w/v)水溶液になるようにNaOHをイオン交換水に溶解させた溶液を
反応液として,反応槽にアルミニウムを0.2g(約100cm2)入れ,反応液
を50ml加えて反応させた。発生した水素を捕集管に導き水中置換で水素
の発生量を求めた。なお,水素の收率は,水蒸気量と気圧の補正を行った。
また,反応溶液の反応前後と反応が終了した溶液を12時間以上静置した後
のpHを測定した。
(2)無機塩類が水素発生に与える影響評価
最適なNaOH濃度が判明した後,さらに発生速度を増大させる方法を検討
する。アルミニウムに無機塩類を添加することにより水素発生速度が変化
する可能性があるので,各種無機塩類を添加した反応液を作製し,それら
の水素発生状態を評価した。
4%(w/v)(1M/L)水溶液になるように NaOHをイオン交換水に溶解
させた溶液を基本の反応液とし,上述の塩類を0.1M/Lになるように溶解(
沈殿が発生する場合は分散)させた反応液を検討した。
反応槽にアルミニウムを0.2g(約100cm2)入れ,反応液を 50ml 加え
て反応させた。発生した水素を捕集管に導き水中置換で水素の発生量を求
めた。水素の收率は,水蒸気量と気圧の補正を行った。また,反応溶液の
反応前後と反応が終了した溶液を 12 時間以上静置した後のpHを測定した。
なお反応液は,8%(w/v)NaOH水溶液100ml と,0.2M/L の無機塩水溶
液 100ml を混合し,純水で200ml としたものを用いた。
(3)無機塩類が反応時の沈殿生成に与える影響評価
アルミニウムと無機塩類が反応した後に,水酸化アルミニウムの沈殿生
成により,反応で低下した pH が回復する可能性があるので,無機塩類が
反応時の沈殿生成に与える影響について評価した。
8%(w/v)アルミン酸ナトリウム水溶液 100ml と,0.2M/L の無機塩水
溶液 100ml を混合し,沈殿の生成状態を観察するとともに,混合直後と
20時間静置後のpHを測定した。ただし8%(w/v)アルミン酸ナトリウム
水溶液は,溶解後,時間とともに沈殿を生成したため,溶解後1日静置し
て沈殿を生成させた後,その上澄み液を用いた。
(4)反応液の最適化
反応後のpHを高くできたFeSO4系反応液とNaCl系反応液の2種類の反応
液を作製して,反応液の最適化を図った。作製した反応液は,8%(w/v)
NaOH水溶液100mlに 0.4M/L の Na3PO4・12H2O 水溶液 50ml を加え,
さらに,0.4M/L の FeSO4・7H2O 水溶液 50ml または 0.4M/L のNaCl 水
溶液 50ml を混合し,純水で200ml としたものを用いた。
(5)水酸化ナトリウム使用量の検証
水素発生における水酸化ナトリウムの使用効率の改善を目指すため,従来
の水酸化ナトリウムのみを使用した溶液と,FeSO4 系反応液を比較して,
水酸化ナトリウムの使用量を調べた。従来の水素発生装置での実験におい
て 500gのアルミニウムに対して,3ℓのNaOH溶液(4%濃度)を用いてきた。
前項の実験結果よりFeSO4 系反応液を作製し,水酸化ナトリウムの使用量
を検証する。溶液濃度が 4%であることから,これまでの反応液では 120
gの水酸化ナトリウムを使用している。
実験では前項と同様にアルミニウム箔(純度:99%以上,厚さ:11μm)
を 15mm角程度の不定形にちぎり使用した。
本研究では,アルミ系廃棄物(産廃,一般廃棄物)を効率よく回収・分
別し,それを最適条件で乾留することで高純度アルミを回収,その回収ア
ルミを反応液とともにカートリッジ化することで,社会のエネルギー需要
をまかなう新規のエネルギーシステムを構築するための技術開発と社会シ
ステム創出を行う。これにより,アルミ資源の利用率を向上させるととも
に,低炭素地域システムを実現することを目的とする。
その中で,アルミと水酸化ナトリウム水溶液を反応させることによって
水素を発生させる研究例は報告されている(5)~(8)が,水酸化ナトリウム
水溶液に添加物を混ぜることによって,水素発生速度を増大させる研究例
は殆どない。
そこで本研究では,アルミと反応させて水素を発生させる反応液として,
水酸化ナトリウム水溶液に様々な無機塩類を添加することによって,水素
発生速度や水素の収率を向上できる反応液を開発したので報告する。
また,アルミ缶やアルミ箔からの水素ガス発生特性に関する基礎的研究が
あるが,金属アルミにリサイクル した方が良いという意見もあるため,水
素利用した方が実験に用いたアルミニウムは,市販アルミホイル(純度:
99%以上,厚さ:11μm)を15mm角程度の不定形にちぎり使用した。
図1に使用したアルミを示す。 試薬には,NaOH,アルミン酸ナトリウム,
Fe2(SO4)3・H2O,FeSO4・7H2O,CuSO4・5H2O,MgSO4,Na2SO4,
FeCl2・4H2O,FeCl3・6H2O,CuCl2・2H2O,CuCl,MgCl2・6H2O,
NaCl,二りん酸鉄(Ⅲ),Na2HPO4,Na3PO4・12H2Oを使用した。
この際,アルミン酸ナトリウム,二りん酸鉄(Ⅲ)はJIS試薬1級を用いた
が,他の試薬はJIS試薬特級を使用。パイレックスガラス器具およびシリコ
ンゴム管を用いて図2に示す様な実験装置を作製。反応槽の内容積は500ml。
反応時,反応槽下部(反応液),反応槽上部(発生ガス),気温,反応槽
バス,捕集管バスの温度を温度センサーを用いて計測し,データロガーを
用いてデータ収集。反応槽バス,捕集管バスは30℃となるようにヒーター
により加温。反応溶液のpHを,pHメーターで計測。
(1)NaOH濃度と水素発生
NaOH濃度と水素発生速度や水素発生量との関係に関する基礎的なデータを
得るため,濃度を変えたNaOH水溶液の水素発生状態を評価1~5%(w/v)
水溶液になるようにNaOHをイオン交換水に溶解させた溶液を反応液とし
反応槽にアルミニウムを0.2g(約100cm2)入れ,反応液を50ml加えて反
応させた。発生した水素を捕集管に導き水中置換で水素の発生量を求めた。
なお,水素の收率は,水蒸気量と気圧の補正を行った。また,反応溶液の
反応前後と反応が終了した溶液を12時間以上静置した後のpHを測定。

(2)無機塩類が水素発生に与える影響評価
最適なNaOH濃度が判明した後,さらに発生速度を増大させる方法を検討。
アルミニウムに無機塩類を添加することにより水素発生速度が変化する可
能性があるので,各種無機塩類を添加した反応液を作製し,それらの水素
発生状態を評価した。
4%(w/v)(1M/L)水溶液になるように NaOHをイオン交換水に溶解さ
せた溶液を基本の反応液とし,上述の塩類を0.1M/Lになるように溶解(沈
殿が発生する場合は分散)させた反応液を検討。 反応槽にアルミニウム
を0.2g(約100cm2)入れ,反応液を 50ml 加えて反応させた。発生した
水素を捕集管に導き水中置換で水素の発生量を求めた。水素の收率は,水
蒸気量と気圧の補正を行った。また,反応溶液の反応前後と反応が終了し
た溶液を 12 時間以上静置した後のpHを測定した。なお反応液は,8%(w
/v)NaOH水溶液100ml と,0.2M/L の無機塩水溶液 100ml を混合し,純
水で200ml としたものを用いた。
(3)無機塩類が反応時の沈殿生成に与える影響評価
アルミニウムと無機塩類が反応した後に,水酸化アルミニウムの沈殿生成
により,反応で低下した pH が回復する可能性があるので,無機塩類が反
応時の沈殿生成に与える影響について評価した。 8%(w/v)アルミン酸ナ
トリウム水溶液 100ml と,0.2M/L の無機塩水溶液 100ml を混合し,沈殿
の生成状態を観察するとともに,混合直後と20時間静置後のpHを測定した。
ただし8%(w/v)アルミン酸ナトリウム水溶液は,溶解後,時間とともに
沈殿を生成したため,溶解後1日静置して沈殿を生成させた後,その上澄み
液を用いた。
(4)反応液の最適化
反応後のpHを高くできたFeSO4系反応液とNaCl系反応液の2種類の反応液
を作製して,反応液の最適化を図った。作製した反応液,8%(w/v)NaO
H水溶液100mlに 0.4M/L の Na3PO4・12H2O 水溶液 50ml を加え,さら
に,0.4M/L の FeSO4・7H2O 水溶液 50ml または 0.4M/L のNaCl 水溶液
50ml を混合し,純水で200ml としたものを用いた。
(5)水酸化ナトリウム使用量の検証
水素発生における水酸化ナトリウムの使用効率の改善た場合にNaOHに比
較して応性が高くなることがわかった。特にFeSO4・7H2OとNaClは反応
初期の水素発生速度が高く水素発生装置開発に有利になるものと考えられる。
3.3 無機塩類が反応時の沈殿生成に与える影響評価
アルミニウムは,水酸化ナトリウム水溶液に溶解してテトラヒドロキシア
ルミン酸ナトリウムを生成し,時間とともに結晶性の水酸化アルミニウム
が沈殿するとされている。
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2 Na[Al(OH)4] → Al(OH)3↓ + NaOH
今回の反応中にも同様の反応が起きていると考えられるが,無機塩類が存
在した場合の影響を考慮する必要があると考えられる。そこで,水に溶
解してテトラヒドロキシアルミン酸ナトリウムとなるアルミン酸ナトリウ
ム水溶液と,各種無機塩水溶液を混合し,沈殿の生成状態を観察した。ま
た,混合直後と20時間静置後のpHを測定した結果を表4に示す。ナトリウ
ム系の塩は沈殿を生成しなかった。これは,アルミン酸ナトリウム水溶液
と,ナトリウム系塩の水溶液を混合してもpHの低下が小さく,高いアルカ
リ性によりテトラヒドロキシアルミン酸イオンが存在しやすいことと,ナ
トリウム塩の水溶液中の溶解性が高いことによるものと考えられた。また
沈殿が生成する系の場合には静置後のpHが混合直後のpHに比べて高くな
る傾向が見られた。これは,上式に示した水酸化アルミニウムの沈殿と水
酸化ナトリウムの生成が起きpHが高くなったものと考えられる。特にFeSO
4・7H2Oでは,静置後のpHが13.25と高く,反応液のpHを高く維持できる
可能性があった。
以上のことから,反応液は,高いアルカリ性を維持することと,pHが低下
した場合には速やかに水酸化アルミニウムの沈殿と水酸化ナトリウムの生
成が起きることが必要であると考えられる。
3.4 反応液の最適化
今回の実験では,水素発生装置における水素発生を効率化するため,反応
液におけるNaOH濃度と水素発生,無機塩類が水素発生に与える影響評価,
無機塩類が反応時の沈殿生成に与える影響評価について検討した。反応液
におけるNaOH濃度と水素発生では,反応液のNaOH濃度を4%(1M/L)と
することとした。無機塩類が水素発生に与える影響評価では,FeSO4・7
H2OとNaClの添加は反応初期の水素発生速度が高くなることがわかった。
また,無機塩類が反応時の沈殿生成に与える影響評価では,反応後に水酸
化アルミニウムの沈殿生成により,反応で低下したpHが回復することがわ
かった。特にFeSO4・7H2Oの場合は,回復後のpHが高い傾向を示した。
また,ナトリウム系の塩では反応液のpHを高く維持できる可能性があるこ
とがわかった。以上のことから,反応液を最適化するために,以下のFeSO4
系反応液とNaCl系反応液の2種類の反応液を作製した。
FeSO4系反応液は,4%NaOH水溶液に0.1M/L FeSO4・7H2Oと0.1M/L
Na3PO4・12H2Oを添加したもので,FeSO4・7H2Oの水素発生の向上と
回復したpHの高さ,およびNa3PO4・12H2Oの反応液のpHを高く維持す
る傾向を組み合わせたものである。
Table 4. Property of inorganic salt and state of reaction liquid.
価について検討した。
反応液におけるNaOH濃度と水素発生では,比較的反応が速く安定してい
る反応液のNaOH濃度を4%(1M/L)とすることとした。無機塩類が水素
発生に与える影響評価では,NaOH 反応液に対して,NaOH+FeSO4・7H2O,
NaOH+MgSO4,NaOH+Na2SO4,NaOH+MgCl2・6H2O,NaOH+NaCl,
NaOH+Na3PO4・12H2O の反応性が高く,特にFeSO4・7H2O と NaCl
の添加は反応初期の水素発生速度が高くなることがわかった。無機塩類
が反応時の沈殿生成に与える影響評価では,反応後に水酸化アルミニウム
の沈殿生成により,反応で低下した pH が回復することがわかった。特に
FeSO4・7H2Oの場合は,回復後のpH が高い傾向を示し,ナトリウム系の
塩では反応液のpHを高く維持できる可能性があることがわかった。
以上の結果から,NaOH,FeSO4・7H2O, Na3PO4・12H2Oを組み合わ
せたFeSO4系反応液とNaOH,NaCl, Na3PO4・12H2O を組み合わせた
NaCl 系反応液を作製してその反応性を評価したところ,水素発生速度は
両反応液ともNaOH 反応液より初期の反応が進み反応時間も短くなること
がわかった。また,反応後静置により pH が回復することも確認できた。
今回,2 種類の反応液を提案したが,課題として以下の点が挙げられる。
・水素発生装置に対する反応液の最適化。
・コスト低減,装置負荷の低減,反応液の安全性向上の点から,反応性を
維持しながら反応液の濃度を下げる検討。
・反応液の保管時の長期安定性の確認。
・反応液を長期間使用した場合の劣化の評価。
今後これらの点を考慮しながら開発を進める必要があ 107
4%NaOH
Reaction liquid with FeSO4
Used amount of NaOH
120g
(a) Residue of 4%NaOH
Fig. 7. Comparison of residues.
る。
3.5 水酸化ナトリウム使用量の検証
45g
(b) Residue of reaction liquid
with FeSO4
濃度4%NaOH 溶液と FeSO4 系反応液を用いて水素発生実験を行い,その
反応について検証した。 表 6に各溶液の水酸化ナトリウム量を,図7(a)に
濃度4%NaOH溶液と図7(b)にFeSO4 系反応液を使用して500gのアルミ
ニウムと反応させた場合の反応残渣をそれぞれ示す。実験結果より,濃度
4%NaOH 溶液の場合ではNaOH の使用量120g,未反応のアルミニウム箔
が残ったが,FeSO4 系反応液では NaOH の使用量 45g,アルミニウム箔
は全反応して溶解し,反応生成物が残った。
このことより,FeSO4 系反応液を用いることで,これまでよりも少ない
NaOH量で水素を発生させることが可能である。また,反応後の水酸化ア
ルミニウムの沈殿により pH の回復が確認できることから,溶液を連続し
て使用することが期待でき,水酸化ナトリウムの使用効率をさらに改善
できると考えられる。
4. おわりに
水素発生方法の基礎技術,水素を効率良く発生させるための技術に関する
知見を得るため,反応液におけるNaOH 濃度と水素発生,無機塩類が水素
発生に与える影響評価,無機塩類が反応時の沈殿生成に与える影響評価に
ついて検討した結果,以下の知見が得られた。
(1) NaOH 濃度と水素発生速度,水素発生量の関係を調べるために,濃度
を1%~5%に変化させて反応実験を実施した結果,濃度の増加とともに水
素の発生速度が増大することがわかったが,4%と5%ではその差が小さい
ことから,濃度は 4%が適切であると思われる。
(2) NaOH,FeSO4・7H2O, Na3PO4・12H2O を組み合わせたFeSO4系
反応液とNaOH,NaCl, Na3PO4・12H2O
3. 実験結果
3.1 水酸化ナトリウム水溶液の濃度と水素発生
NaOH 濃度と水素発生速度や水素発生量との関係に関する基礎的なデータ
を得るため,濃度を変えたNaOH水溶液の水素発生状態を評価した。いず
れの場合も反応が始まるとアルミニウムの表面に水素の気泡が発生してア
ルミニウムは反応溶液表面で反応した。反応が終了(水素捕集が1分間見
られない)すると反応液中に黒色の反応生成物が生成した。この生成物は
反応溶液中で時間が経過すると褐色に変色した。 
上図 3,図 4にNaOH濃度と水素発生速度,水素発生量の関係を示す。濃度
が高くなると,反応速度が増加し,反応が終了するまでの時間が短くなる
ことがわかる。なお,1%,2%の場合は反応終了時に未反応のアルミニウ
ムが見られた。表1にNaOH濃度を変えた水溶液の反応性を示す。NaOH濃
度が高くなると,最大水素発生速度が高くなり,反応時間や上昇時間が短
くなることがわかる。
変化の度合いは,1%から3%までは比較的大きいが,3%から5%までは変
化の度合いが小さくなる結果となった。これは,反応前のpHの傾向と一致
することから,反応液のpHが反応性に影響することがわかる。また,反応
時間や上昇時間が4%と5%でほとんど変わらないのは,20%等の高濃度の
反応液で見られたように,反応時の水素によるアルミニウムの浮き上がり
が要因となる反応の非均一性が影響しているものと考えられる。このこと
から,4%(1M/L) NaOH水溶液が反応速度と反応の状態のバランスが
取れているものと判断した。
3.2 無機塩類が水素発生に与える影響評価
NaOH濃度が4%のときに水素発生速度等の性能が優れていることが判明し
たが,さらに発生速度を増大させる方法を検討した。NaOH溶液によるア
ルミニウムの溶解と水素発生は,アルカリによるアルミニウムの腐食と考
えることができる。アルミニウムの腐食は塩類の共存によりその速度が変
化することから,各種無機塩類を添加した反応液を作製しそれらの水素発
生状態を評価した。 表2に無機塩の性質と反応液の状態を示す。多くの無
機塩は水に可溶であるが,強アルカリである反応液の状態では主に水酸化
物と考えられる沈殿を生じた。ナトリウム塩類は反応液では沈殿が見られ
なかった。
表3に各種無機塩を添加した反応液の反応性を示す。
塩の添加により反応液の反応性が変化することがわかる。反応性の指標と
なる最大発生速度,水素收率,反応時間,上昇時間を見ると,NaOHに比
較して反応性が高いと考えられるものは,NaOH+FeSO4・7H2O,NaOH+
MgSO4,NaOH+Na2SO4,NaOH+MgCl2・6H2O,NaOH+NaCl,
NaOH+Na3PO4・12H2Oであった。銅系の塩類では反応性は高いものの,
收率が悪い結果を示した。 銅系の塩類を除く反応性が高い無機塩の反応液
の反応速度変化を示したものが図5である。NaOHに対して発生速度が高く
維持されていることがわかる。特にNaOH+FeSO4・7H2O,NaOH+NaCl
では,反応初期の水素発生速度が高くなり,開発する水素発生装置の反応
立ち上げや制御に有利になるものと考えられる。
以上の結果から,アルカリ溶液を用いて水素発生を行う場合,無機塩を添
加することにより反応性が変化することがわかった。無機塩の中では,
FeSO4・7H2O,MgSO4,Na2SO4,MgCl2・6H2O,NaCl,Na3PO4・
12H2Oを添加し



た場合にNaOHに比較して反応性が高くなることがわかった。特にFeSO4
・7H2OとNaClは反応初期の水素発生速度が高く水素発生装置開発に有利
になるものと考えられる。
3.3 無機塩類が反応時の沈殿生成に与える影響評価
アルミニウムは,水酸化ナトリウム水溶液に溶解してテトラヒドロキシア
ルミン酸ナトリウムを生成し,時間とともに結晶性の水酸化アルミニウム
が沈殿するとされている。
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
Na[Al(OH)4] → Al(OH)3↓ + NaOH
今回の反応中にも同様の反応が起きていると考えられるが,無機塩類が存
在した場合の影響を考慮する必要があると考えられる。そこで,水に溶解
してテトラヒドロキシアルミン酸ナトリウムとなるアルミン酸ナトリウム
水溶液と,各種無機塩水溶液を混合し,沈殿の生成状態を観察した。また,
混合直後と20時間静置後のpHを測定した結果を表4に示す。ナトリウム系
の塩は沈殿を生成しなかった。これは,アルミン酸ナトリウム水溶液と,
ナトリウム系塩の水溶液を混合してもpHの低下が小さく,高いアルカリ性
によりテトラヒドロキシアルミン酸イオンが存在しやすいことと,ナトリ
ウム塩の水溶液中の溶解性が高いことによるものと考えられた。また,沈
殿が生成する系の場合には静置後のpHが混合直後のpHに比べて高くなる
傾向が見られた。これは,上式に示した水酸化アルミニウムの沈殿と水酸
化ナトリウムの生成が起きpHが高くなったものと考えられる。特にFeSO4・
7H2Oでは,静置後のpHが13.25と高く,反応液のpHを高く維持できる可
能性があった。
以上のことから,反応液は,高いアルカリ性を維持することと,pHが低下
した場合には速やかに水酸化アルミニウムの沈殿と水酸化ナトリウムの生
成が起きることが必要であると考えられる。
3.4 反応液の最適化
今回の実験では,水素発生装置における水素発生を効率化するために,反
応液におけるNaOH濃度と水素発生,無機塩類が水素発生に与える影響評
価,無機塩類が反応時の沈殿生成に与える影響評価について検討した。反
応液におけるNaOH濃度と水素発生では,反応液のNaOH濃度を4%(1M/L)
とすることとした。無機塩類が水素発生に与える影響評価では,FeSO4・
7H2OとNaClの添加は反応初期の水素発生速度が高くなることがわかった。
また,無機塩類が反応時の沈殿生成に与える影響評価では,反応後に水酸
化アルミニウムの沈殿生成により,反応で低下したpHが回復することがわ
かった。特にFeSO4・7H2Oの場合は,回復後のpHが高い傾向を示した。
また,ナトリウム系の塩では反応液のpHを高く維持できる可能性があるこ
とがわかった。以上のことから, 
反応液を最適化するために,以下のFeSO4系反応液とNaCl系反応液の2種
類の反応液を作製することとした。 FeSO4系反応液は,4%NaOH水溶液
に0.1M/L FeSO4・7H2Oと0.1M/L Na3PO4・12H2Oを添加したもので,
FeSO4・7H2Oの水素発生の向上と回復したpHの高さ,およびNa3PO4・
12H2Oの反応液のpHを高く維持する傾向を組み合わせたものである。
NaCl 系反応液は,4%NaOH 水溶液に 0.1M/L NaCl と0.1M/L Na3PO4・
12H2O を添加したもので,NaCl の水素発生の向上と,NaCl および Na3
PO4・12H2O の反応液のpHを高く維持する傾向を組み合わせたものであ
る。
反応液は,8%(w/v)NaOH水溶液 100mlに 0.4M/LのNa3PO4・12H2O
水溶液 50ml を加え,さらに,0.4M/L のFeSO4・7H2O 水溶液 50ml また
は 0.4M/L の NaCl 水溶液50ml を混合し,純水で200mlとしたものを用い
た。
両反応液について,ⅱ)無機塩類が水素発生に与える影響評価と同様に水
素発生実験を行った結果を図6および表5に示す。ただし静置後のpH測定は
48時間後に行った。水素発生速度は両反応液ともNaOH反応液より初期の
反応が進み反応時間も短くなることがわかる。また,反応後静置によりpH
が回復することも確認できた。
水素発生方法の基礎技術,水素を効率良く発生させるための技術に関する
知見を得るため,反応液におけるNaOH 濃度と水素発生,無機塩類が水素
発生に与える影響評価,無機塩類が反応時の沈殿生成に与える影響評価に
ついて検討した。 反応液におけるNaOH濃度と水素発生では,比較的反応
が速く安定している反応液のNaOH濃度を4%(1M/L)とすることとした。
無機塩類が水素発生に与える影響評価では,NaOH 反応液に対して,NaOH
+FeSO4・7H2O,NaOH+MgSO4,NaOH+Na2SO4,NaOH+MgCl2・
6H2O,NaOH+NaCl,NaOH+Na3PO4・12H2O の反応性が高く,特に
FeSO4・7H2O と NaCl の添加は反応初期の水素発生速度が高くなることが
わかった。無機塩類が反応時の沈殿生成に与える影響評価では,反応後に
水酸化アルミニウムの沈殿生成により,反応で低下した pH が回復すること
がわかった。特にFeSO4・7H2Oの場合は,回復後のpH が高い傾向を示し,
ナトリウム系の塩では反応液のpHを高く維持できる可能性があることがわ
かった。
以上の結果から,NaOH,FeSO4・7H2O, Na3PO4・12H2Oを組み合わ
せたFeSO4系反応液とNaOH,NaCl, Na3PO4・12H2O を組み合わせた
NaCl 系反応液を作製してその反応性を評価したところ,水素発生速度は
両反応液ともNaOH 反応液より初期の反応が進み反応時間も短くなること
がわかった。また,反応後静置により pH が回復することも確認できた。
今回,2 種類の反応液を提案したが,課題として以下の点が挙げられる。
・水素発生装置に対する反応液の最適化。
・コスト低減,装置負荷の低減,反応液の安全性向上の点から,反応性を
維持しながら反応液の濃度を下げる検討。
・反応液の保管時の長期安定性の確認。
・反応液を長期間使用した場合の劣化の評価。
今後これらの点を考慮しながら開発を進める必要がある。 
3.5 水酸化ナトリウム使用量の検証
4濃度4%NaOH 溶液と FeSO4 系反応液を用いて水素発生実験を行い,その
反応について検証した。
表6に各溶液の水酸化ナトリウム量を,図7(a)に濃度4%NaOH溶液と図7
(b)にFeSO4 系反応液を使用して500gのアルミニウムと反応させた場合の
反応残渣をそれぞれ示す。実験結果より,濃度 4%NaOH 溶液の場合では
NaOH の使用量120g,未反応のアルミニウム箔が残ったが, FeSO4 系反
応液では NaOH の使用量 45g,アルミニウム箔は全反応して溶解し,反応
生成物が残った。
このことより,FeSO4 系反応液を用いることで,これまでよりも少ない
NaOH量で水素を発生させることが可能である。また,反応後の水酸化ア
ルミニウムの沈殿により pH の回復が確認できることから,溶液を連続し
て使用することが期待でき,水酸化ナトリウムの使用効率をさらに改善で
きると考えられる。反応液を最適化するために,以下のFeSO4系反応液と
NaCl系反応液の2種類の反応液を作製することとした。
FeSO4系反応液は,4%NaOH水溶液に0.1M/L FeSO4・7H2Oと0.1M/l
Na3PO4・12H2Oを添加したもので,FeSO4・7H2Oの水素発生の向上と
回復したpHの高さ,およびNa3PO4・12H2Oの反応液のpHを高く維持す
る傾向を組み合わせたものである。
4. おわりに
水素発生方法の基礎技術,水素を効率良く発生させるための技術に関する
知見を得るため,反応液におけるNaOH 濃度と水素発生,無機塩類が水素
発生に与える影響評価,無機塩類が反応時の沈殿生成に与える影響評価に
ついて検討した結果,以下の知見が得られた。
(1) NaOH 濃度と水素発生速度,水素発生量の関係を調べるために,濃度
を1%~5%に変化させて反応実験を実施した結果,濃度の増加とともに水
素の発生速度が増大することがわかったが,4%と5%ではその差が小さい
ことから,濃度は 4%が適切であると思われる。
(2) NaOH,FeSO4・7H2O, Na3PO4・12H2O を組み合わせたFeSO4系
反応液とNaOH,NaCl, Na3PO4・12H2O組み合わせた NaCl 系反応液作
製してその反応性を評価したところ,水素発生速度は両反応液ともNaOH
反応液より初期の反応が進み,反応時間も短くなることがわかった。
(3) 水酸化ナトリウムの使用量について,アルミ500gに対して 4%の水酸化
ナトリウム水溶液(水酸化ナトリウム120g使用)と反応液(水酸化ナトリ
ウム45g使用)を比較したところ,水酸化ナトリウム水溶液は未反応のアル
ミがあったが,反応液は全て反応し,水酸化ナトリウム使用量を抑えるこ
とができた。
この項了」
🪄ネオコンバーテックでも、ハイブリッド半導体製造材料工学でも、水素
社会事業でも、蓄電池・電池・ハイブリッド電池でも「アルミ」がキーワ
ードとなっているように、社会・自然科学の「三角」が浮上している。「
微弱な電磁力の魔法の力」が浮上しどデカイ元素として見直されている。
実に面白い🎈
![]()


























※コメント投稿者のブログIDはブログ作成者のみに通知されます